Angewandte Epigenetik: EBOP® – Epigenetic Burnout Protector
 EBOP® – Epigenetic Burnout Protector
EBOP® – Epigenetic Burnout Protector
Ein Nahrungsergänzungsmittel der Angewandten Epigenetik mit der höchst möglichen biologisch aktiven Form von S-Adenosyl-L-Methionin als gecoatetes Granulat, mit den für seine Biosynthese wichtigen Vitaminen und einem Spurenelement in präventiver Dosierung in magensaftresistenten Kapseln.
Schützt vor Burnout und verbessert die Widerstandskraft (Resilienz)
„Burnout wird definiert durch die WHO als Syndrom aufgrund von „chronischem Stress am Arbeitsplatz, der nicht erfolgreich verarbeitet wird“.
Ein „toxisches Arbeitsumfeld“ führt zu toxischem Stress.
Burn-out ist eine Erfahrung, die zu Krankheiten führen kann (Christina Maslach).
Die Symptome von Burnout:
- körperliche und psychische Erschöpfung
- negative Selbsteinschätzung der eigenen Belastbarkeit und der beruflichen Kompetenz
- negative Gefühle in Bezug auf die Arbeit
- Verlust der mitfühlenden Grundhaltung gegenüber den Klienten
Epigenetische Zusammenhänge
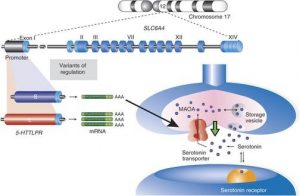
◊ Eine Genvariante des Serotonintransporter-Gens (Variante „K“) führt zur Dysfunktion der serotonergen Synapse mit funktionellem Serotoninmangel, bei normalem Serotonin-Plasmaspiegel
Das endogene Peptidhormon Serotonin erfüllt wichtige physiologische Aufgaben im Verdauungstrakt, im Blutkreislauf aber auch im zentralen Nervensystem.
Serotonin kann die Blut-Hirn-Schranke nicht überwinden. Das vom
Gehirn benötigte Serotonin wird von den Neuronen synthetisiert (Birdsall, 1998).
Die Serotoninsynthese wird unter normalen Bedingungen über die Verfügbarkeit von Tryptophan an den serotonergen Neuronen reguliert (Peters, 1991).
Die Aufnahme von Tryptophan ins Gehirn erfolgt über ein Transportersystem, an dem Tryptophan mit den verzweigtkettigen Aminosäuren Valin, Leucin, Isoleucin, Tyrosin und Phenylalanin (large neutral amino acids, LNAA) konkurriert. Hierbei hängt die Transportrate für Tryptophan im wesentlich vom Verhältnis des freien Tryptophans zu den anderen LNAA ab (Perez-Cruet et al., 1974; Fernstrom et al., 1979).
Im Gehirn dient es als Neurotransmitter und leitet Signale zwischen Nervenzellen weiter. Dabei ist Serotonin der phylogenetisch älteste und in allen Teilen des Gehirns wirkende Neurotransmitter.
Der größte Anteil der serotonergen Neurone liegt im Mittelhirn im Bereich der Raphekerne der Pons. Von dort projizieren die serotonergen Neurone stark verzweigt in alle Teile des Gehirns.
Serotonin ist im Volksmund allgemein als „Glückshormon“ bekannt ist.
Die Epigenetik zeigt uns, dass das Epigenom als „physikalischer Rezeptor“ wirkt. Belastungen und Einflüsse aus dem Umfeld, die Qualität und Quantität der Ernährung, das Rauchen, Alkoholabusus, der Mangel an körperlicher Bewegung, Einsamkeit, Trauer, Störungen des Tagesrhythmus (Jet Lag, Schichtarbeit, Schlafentzug), sogar Mangel an Grünflächen, sie alle haben Auswirkungen, ob sie als „Stress“ oder nicht wahrgenommen werden. Selbst Erfahrungen und Emotionen können ihrerseits in einem epigenetischen Prozess auf die Gene modulierend wirken.
Eine plausible Erklärung für den funktionellen Serotoninmangel ist, dass Umweltstressoren das Serotoninsystem durch epigenetische Prozesse umprogrammieren, indem sie die Genexpression des Serotoninsystems verändern.
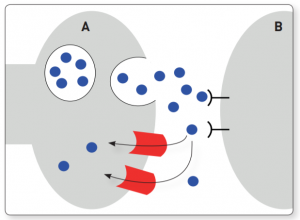
Eine Zunahme der Expression des Serotonintransporter -Gens SLC6A4 verursacht eine Zunahme der Anzahl von Serotonin-Transportern-Protein. Mit mehr Serotonin-Transportern wird mehr Serotonin in die Präsynapse rücktransportiert, förmlich aus dem synaptischen Spalt in die Präsynapse „abgesaugt“, was letztendlich zu einem funktionellen Serotonin-Mangel im synaptischen Spalt und den Rezeptoren der postsynaptischen Membran führt.
Der Serotonintransporter begrenzt auf diese Weise die Dauer des Serotonin-basierten Signals und sorgt für einen sparsamen Umgang mit dem zellulären Energiehaushalt.
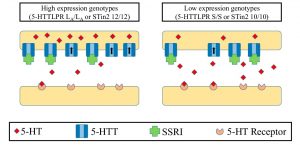
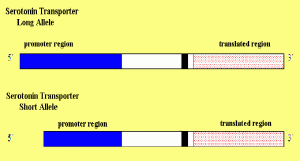
⇒ Ein Polymorphismus in der Promotorregion des Serotonintransporter-Gens SLC6A4 weist eine verkürzte Genvariante des Serotonintransporter-Gens (Variante „K“) auf und ist assoziiert mit Angsterkrankungen, Zwangsstörungen, toxischem Stress, depressiven Störungen und Burnout. Auch bei Fibromyalgie und erniedrigter Schmerzschwelle findet sich die verkürzte Genvariante des Serotonintransporters.
Eine verkürzte Variante des Serotonintransporter-Gens (Variante „K“) führt zu einer Verminderung der Anzahl an Serotonintransporter-Molekülen auf der Nervenzelle und somit zu einem funktionellen Serotoninmangel an der Synapse auf Grund einer geringeren Ansprechbarkeit.
Diese Varianten des Serotonin-Transporter- Gens beeinflussen Persönlichkeitsmerkmale und psychiatrische Erkrankungen.
Sie sind ängstlich, wenn Sie das Short / Short-Paar für den Serotonin-Transporter erben und sie werden daher weniger in der Lage sein, ängstliche Situationen bei Konflikten, Traumata und Verlusten zu bewältigen. Es könnte also sein, dass kurze Serotonintransporter – Allele zu einem erhöhten Risiko für Depressionen führen.
◊ Fibromyalgie-Patienten haben gehäuft die kurze Genvariante des Serotonin-Transporters
Die familiäre Häufung der Fibromyalgie (Buskila et al., 1996; Buskila und Neumann, 1997; Offenbächer et al., 1998) lässt eine genetische Komponente bei der Fibromyalgie wahrscheinlich werden. Angehörige von Fibromyalgie-Patienten haben nicht nur ein deutlich erhöhtes Risiko ebenfalls an Fibromyalgie zu erkranken, sondern es konnte auch eine erniedrigte Schmerzschwelle in Fibromyalgiefamilien beobachtet werden (Arnold et al.,2004).
Auch von molekulargenetischer Seite gibt es erste Hinweise auf genetische Faktoren. In einer Untersuchung zum Polymorphismus der Promotorregion des Serotonintransporter-Gens fand sich bei Fibromyalgie-Patienten gehäuft die kurze Genvariante (Offenbächer et al.,1999), die mit einer herabgesetzten Transkriptionsaktivität des Gens einhergeht (Heils et al.,1996). Der carriervermittelte Serotoninrücktransport in das präsynaptische Neuron spielt eine entscheidende Rolle in der Feinabstimmung der serotonergen Neurotransmission, da er zusammen mit der Serotoninfreisetzung die Höhe und Dauer der postsynaptischen Antwort regelt (Heils et al., 1996). Als klinische Korrelation erzielten Patienten mit der kurzen Genvariante höhere Werte in psychopathologischen Ratrings (Offenbächer et al., 1999).
◊ Krankheitssymptome bei Serotonin-Defizienz:
Ein Verdacht auf funktionelle Serotonin-Defizienz bei normalem Serotoninspiegel besteht bei Chronic Fatigue-Symptomatik, Antriebslosigkeit, Stimmungseinengung, Verlust der affektiven Resonanz, Angst und Schlafstörungen.
Stimmungseinengung, Verlust der affektiven Resonanz, Angst, Antriebshemmung und Schlafstörungen sind die wichtigsten Symptome bei Erkrankungen aus dem depressiven Formenkreis.
◊ Aus Serotonin wird Melatonin synthetisiert mit seiner schlaffördernden Wirkung
Melatonin, ist ein aus der Zirbeldrüse synthetisiertes Neurohormon. Melatonin steuert den Tag-Nacht-Rhythmus und hat eine schlaffördernde Wirkung.
Mit dem „Timezyme”, Acetylserotonin-O-Methyltransferase, wird aus Serotonin das N-Acetylserotonin, das mit Hilfe von S-Adenosylmethionin (Ademetionin) methyliert wird und es entsteht Melatonin.
Melatonin beeinflusst die Neurogenese und ist neuroprotektiv u.a. bei der Alzheimer-Erkrankung.
Melatonin zeigt seine neuroprotektiven Funktionen durch die Blockierung der Aβ-Produktion, Aβ-Oligomerisierung und -Fibrillation, Tau-Hyperphosphorylierung, synaptische Dysfunktion, oxidativen Stress und neuronalen Tod während der Alzheimer Demenz-Progression.
Melatonin spielt eine entscheidende Rolle bei der Hemmung der circadianen Störung, indem es die Clock-Gene kontrolliert und die Aβ-Akkumulation und die Tau-Hyperphosphorylierung durch Regulierung des Signalwegs der Glykogensynthase-Kinase-3 (GSK3) und der Cyclin-abhängigen Kinase-5 (CDK5) abschwächt.
Hossain MF et al. Melatonin bei Alzheimer: Ein latenter endogener Regulator der Neurogenese zur Linderung der Alzheimer-Neuropathologie. Mol Neurobiol. 2019 Jun 17.
◊ Ausreichend Serotonin im Gehirn führt zu einem Oxytocin Anstieg und hilft bei der sozialen Anerkennung
Die soziale Anerkennung wird durch ein Netzwerk von Oxytocin-sensitiven Neuronen im Hippocampus reguliert.
Oxytocin ist der vermutlich bindungsstiftendste Neurotransmitter, der bisher beim Menschen gefunden wurde.
Angesichts der zentralen Rolle des Oxytocin – Systems in Bezug auf soziales Verhalten, Bindung, Angst und Stressverarbeitung ist das Oxytocin-Rezeptor-Gen ein Schlüsselkandidatengen für die molekulargenetischen Grundlagen der verhaltensbezogenen und psychologischen Folgen von Verlusterlebnissen.
Der Oxytocinrezeptor liegt in zwei Varianten vor, als „A“ oder „G“-Form. Da jeder Mensch eine Kopie des Gens von jeweils einem Elternteil erhält, existieren drei verschiedenen Kombinationen in der Bevölkerung: AA, AG und GG.
Personen der GG-Gruppe unterschieden sich signifikant, sowohl im Stressverhalten, wobei Frauen insgesamt etwas sensibler gegenüber Stress reagieren, als auch in der Empathiefähigkeit von denen mit AA oder AG-Kombination.
◊ Erhöhte Aktivität der neuronalen Stress-Achse als Folge von toxischem Stress
Ein durch Stresshormone gesteuertes System, die HPA- Achse (Hypothalamus- Hypophysen- Nebennierenrinden- Achse mit ACTH = adrenocorticotrope Hormon, CRH / AV = corticotropin releasing Hormon / Arginin – Vasopressin, GABA = Gammaaminobuttersäure koordiniert Gehirn (Wahrnehmung=Kognition) und Körper (Reaktion=physische Möglichkeit sich der Gefahr zu entziehen).
Die neuronale Stressreaktion ist kurzfristig anpassungsfähig und vorteilhaft, kann jedoch, wenn sie übermäßig aktiviert wird, zu veränderten körperlichen Reaktionen auf Stress führen.
Eine ständig subjektive Belastung ist mit erhöhten Noradrenalin-, Adrenalin- und Cortisol- Werten verbunden. Es fehlt an einer Relaxationsphase. Die Herzfrequenz und die Blutdruckwerte sind erhöht und die Immunkompetenz ist geschwächt und der toxische Stress hat einen negativen Einfluss auf die Lebenserwartung der Betroffenen.
◊ Stress erhöht bei Gesunden den Serotoninspiegel ebenso wie den Noradrenalin, Dopamin– und Cortisolspiegel.
Die Erhöhung des Cortisolspiegels nach toxischen Stress (McEwen) wird durch Aktivierung des adrenergen Systems und der α1-adrenergen Rezeptoren vermittelt, indem eine starke Noradrenalin-Erhöhung alpha1-Adrenozeptoren im Hypothalamus aktiviert und dadurch zur Ausschüttung des Stresshormons CRH (Corticotropin-Releasing-Hormon) führt, das die weiteren Stufen der HPA-Achse aktiviert.
Das fettlösliche Cortisol kann leicht die Blut-Hirn-Schranke passieren und beeinflusst die Expression zahlreicher Gene, indem Cortisol als sogenannter Transkriptionsfaktor (Bildung von Protein/Enzym am Genort) fungiert.
◊ Der Hippocampus, eine Region des Gehirns mit dichter serotonerger Innervation, ist wichtig für die Stressregulation
Das Gehirn ist ein Ziel stressiger Erfahrungen und Glukokortikoide sowie Neurotransmitter vom Typ der exzitatorischen Aminosäuren verändern die neuronale Architektur, indem sie je nach Hirnregion eine dendritische Retraktion oder Expansion und eine verminderte oder erhöhte Synapsendichte. Toxischer Stress führt zu einer Abnahme der Neuroneogenese im Gyrus dentatus des Hippocampus, was eine verringerte Proliferation, Überlebensrate und Differenzierung neuronaler Stammzellen zur Folge hat.
Unter toxischem Stress und als Reaktion auf ständig erhöhtes Cortisol unterliegt der Gyrus dentatus, jener Teil der Hippocampus-Formation, wo über die Langzeit-Gedächtnis-Speicherung entschieden wird, einer Verringerung der Zellzahl durch Hemmung der Neurogenese, wohingegen körperliche Aktivität und ein angereichertes Umfeld das Volumen des Gyrus dentatus und die Neuronenzahl erhöhen.
Dysreguliertes Glutamat als exzitatorische Aminosäure unterdrückt die Neurogenese und verursacht die Schrumpfung von Dendriten.
◊ Toxischer Stress führt zu Hypomethylierung des Glucocortcoid – Rezeptor – Genortes und damit zu erhöhter MaoB- Expression.
Bei toxischem Stress kommt es zuerst zu einem Dopaminanstieg im präfrontalen Cortex (PFC), aber langfristiger toxischer Stress führt über eine Downregulation (Erhöhung der Anzahl der Dopamintransporter und Dopaminrezeptoren) zu einer Verringerung des Dopaminspiegels im präfrontalen Cortex.
◊ Cortisol erhöht die MaoA und MaoB-Aktivität
Cortisol aktiviert die MAOA- und MAOB-Gen – Expression, die als Enzyme für den Abbau der monoaminergen Gehirnbotenstoffe (Dopamin, Serotonin, Adrenalin, Noradrenalin) zuständig sind. Die bei der oxidativen Desaminierung gebildeten toxischen Endprodukte führen zu mitochondrialer Dysfunktion und wirken in Folge neurotoxisch mit dem Ergebnis der Neurodegeneration und Astrogliose.
Im menschlichen Gehirn sind etwa 75% des MAO vom B-Subtyp (Saura Marti et al., 1990).
◊ Toxischer Stress und seine Rolle bei der Entstehung der Alzheimerkrankheit
Toxischer Stress und eine überaktive Stress-Achse im Gehirn, HPA-Achse (hypothalamic–pituitary–adrenal- axis) genannt, spielen ebenfalls eine bedeutende Rolle bei der Entstehung der Alzheimerkrankheit.
Toxischer Stress gilt entsprechend auch als ein wesentlicher Risikofaktor für die Entwicklung der Alzheimerkrankheit, kann aber auch eine Folge der Erkrankung sein (Gil-Bea und Kollegen, 2010 im Journal of Alzheimer’s Disease veröffentlicht).
◊ Ist Demenz und Depression eine Fehlfunktion der Neurogenese und der Neuroprotektion?
Die gegenwärtigen Konzepte von Depression und zerebraler Alterung wurden von einer Fehlfunktion der Neurotransmission zu einer Fehlfunktion der Neurogenese und Neuroprotektion geändert (Bettina H. Bewernick 2013).
Neuronen sind einzigartige Zellen, die während der gesamten Lebensdauer bestehen bleiben und programmierte Entwicklungsänderungen und Umwelterfahrungen sammeln, die die neuronalen Schaltkreise im Gehirn optimieren. Während der Entwicklung und Reifung durchlaufen Neuronen genau koordinierte Kaskaden genetischer Regulation, die sich mit Erfahrung verbinden, um die zelluläre Produktion durch fortschreitende Veränderungen des Epigenoms zu formen.
◊ Neurogenese (Neubildung von Neuronen)
Es wurde gezeigt, dass die Neurogenese durch körperlichen und sozialen Stress, Depressionen und eine Behandlung mit Antidepressiva gehemmt werden kann.
Berton O., Nestler EJ. Neue Ansätze zur Entdeckung von Antidepressiva: jenseits von Monoaminen. Nat Rev Neurosci. 2006; 7: 137–151.
◊ DNA-Methylierung
Die DNA-Methylierung ist eine integrale Facette des Epigenoms, die eine Rolle bei der Ermittlung der Zellidentität und der Entwicklungsverläufe sowie bei der Anpassung an die Erfahrung über die Regulation der Genexpression spielt.
Methylierung bedeutet das chemische Anfügen einer Methylgruppe, -CH3 (s. Abbildung). Epigenetische Veränderungen in Form von DNA-Methylierungen betreffen dabei immer nur Cytosin-Nukleotide und besonders dann, wenn diese in DNA-Sequenzumgebungen vorkommen, die reich an der Nukleotidabfolge Cytosin-Guanin (CG) sind, die sogenannten „CpG-Inseln“. Die Anfügung der Methylgruppe übernimmt dabei das Enzym DNA-Methyltransferase (DNMT).
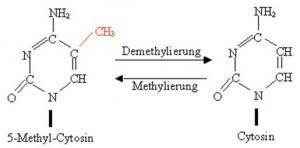
Als Zwei-Basen-Sequenzmotive finden sich die Cytosine in CpH-Kontexten mit (H = A (Adenin), = T (Thymin) oder = C (Cytosin))
Bei Cytosine in CpG-Kontexten ist die Nukleotidfolge Cytosin-Guanin (häufig wiederholt in CpG-Inseln)
Eine reichliche neuronale CpH-Methylierung korreliert stark mit der benachbarten CpG-Methylierung.
◊ Der aktive Racematteil von Ademetionin (S-Adenosylmethionin) vermeidet die Untermethylierung am DNA-Code der Erbsubstanz
Die aktive Form des Ademetionins (S-Adenosylmethionin) ist der wichtigste und einzige Methylgruppen-Donator für die Erbsubstanz unseres Körpers und sorgt für eine ausreichende Methylierung des DNA-Codes und für den Genort der Monoaminooxidase B (MAOB), der epigenetisch stillgelegt wird.
Ein „gene silencing“, die Stilllegung der Genexpression am Genort der Monoaminooxidase B (MaoB), wird möglich. MaoB-Protein wird nicht mehr gebildet. Es kommt zu keinem forcierten Abbau von Serotonin, Phenylethylamin, Noradrenalin und Adrenalin.
Die spürbaren Folgen sind: Stimmungsstabilität, Glücksgefühl, Antriebssteigerung und Motivationsbereitschaft.
◊ Benifits des „gene silencing“ mit Ademetionin durch Methylgruppendonation an die DNA
# das SERT SLC6A4-Gen und damit die Neubildung des selektiven Serotonin-Transporter-Proteins stillzulegen = antidepressive Wirkung,
# das NR3C1-Gen und damit den Glucocorticoid-Receptor stillzulegen = MAOB wird bei toxischem Stress nicht exprimiert und
# den Genort der Monoaminoxidasen (MAO´s) stillzulegen und damit den Abbau der Monamine, wie Dopamin, mit seinen zytotoxischen Abbauprodukten und damit mitochondriale Dysfunktion und neurodegenarative Erkrankungen, wie zum Beispiel die Alzheimer Krankheit mit spätem Beginn, zu verhindern.
EBOP® – Epigenetic Burnout Protector besteht aus im Körper natürlich vorkommenden Substanzen:
-
Ademetionin (S-Adenosylmethionin)
Die Produktion von S-Adenosylmethionin (Ademetionin) beim Menschen findet hauptsächlich in der Leber statt.
Ein lebergesunder, unter 30 Jahre alter Erwachsener synthetisiert ungefähr 8 Gramm S-Adenosylmethionin (Ademetionin) pro Tag.
Das natürliche Vorkommen von Ademetionin in der Zelle und seine Biosynthese in den Leberzellen, nehmen mit dem 35. Lebensjahr ab.
- Dieser vom Lebensalter abhängige Ademetionin-Mangel führt zu Hypomethylierung (Untermethylierung) der DNA und hat Krankheiten zur Folge.
Zu ihrem Vorteil verwenden wir:
ADOGRAN® ist ein gecoatetes (säure- und wasserfestes) Granulat von Ademetionin und eine säurefeste Kapsel-Hülle schützen die Integrität der aktiven Form von S-Adenosylmethionin (Ademetionin).
-
Vitamin B12
unterstützt die Stoffwechselfunktionen unserer Gehirnzellen, welche die normale Funktion des Nervensystems und die normalen psychischen Funktionen erhalten (nach Verordnung (EU) Nr. 432/2012).
Vitamin B12 unterstützt die Ademetionin-Produktion.
Zu ihrem Vorteil verwenden wir:
Vitamin B12 liegt in unserem Produkt als HYDROXOCOBALAMIN vor. Unter allen Vitamin B12-Formen hat Hydroxocobalamin die beste Depotwirkung in der Gehirnzelle. Es bindet sich besonders gut an die Transportmoleküle des Körpers, so dass es sehr lange im Blut zirkuliert und problemlos in den Organen (Nerven, Muskel, Gehirn) in eine der bioaktiven Formen Methylcobalamin oder Adenosylcobalamin spontan umgewandelt werden kann.
-
Folsäure
trägt zu einer normalen Aminosäuresynthese bei und unterstützt die dispositionelle Bereitstellung der essentiellen Aminosäure Methionin im Kohlenstoff 1-Zyklus.
Folsäure trägt zu einem normalen Homocystein-Stoffwechsel bei, wobei der Risikofaktor der Hyperhomozyteinämie vermieden werden kann.
Folsäure trägt zur normalen psychischen Funktion bei, da es Methionin bereitstellt und für genügend Ademetionin-Synthese sorgt.
Folsäure trägt zu einer normalen Funktion des Immunsystems bei.
(nach Verordnung (EU) Nr. 432/2012)
Zu ihrem Vorteil verwenden wir:
QUATREFOLIC® (das Glucosaminsalz von 5-Methyltetrahydrofolat).
Die Methyltetrahydrofolatreduktase (MTHFR) katalysiert die Synthese von 5-Methyltetrahydrofolat, einem Methylgruppen-Spender für die Methioninsynthese. L-Methionin ist ein Vorläufer von Ademetionin.
Die häufigste Mutationsvariante bei der Folsäure ist eine Punktmutation in Position 677. So findet sich bei homozygoten (zwei identische Allele) Trägern des Erbmerkmals, bei 5 bis 20% der Bevölkerung, ein 50%iger Aktivitätsverlust. Dieser Polymorphismus im MTHFR-Gen vom Typ 677T führt oft zu milden bis moderater Erhöhung der Homocysteinkonzentration im Plasma, speziell bei niedrigem B12- oder Folsäure-Status.
Eine Hyperhomocysteinämie ist ein etablierter Risikofaktor für kardiovaskuläre Erkrankungen, nichtalkolische Fettleber und verursacht nachweislich Alzheimer-Pathologie.
Quatrefolic® (das Glucosaminsalz von 5-Methyltetrahydrofolat) ist die sogenannte vierte Generation des Folats. Seine hohe Bioverfügbarkeit vermeidet eine Hyperhomocysteinämie.
-
Vitamin B6 trägt zur normalen psychischen Funktion bei.
Vitamin B6 trägt zu einem normalen Homocystein-Stoffwechsel bei.
Vitamin B6 trägt zur Verringerung von Müdigkeit und Ermüdung bei.
(nach der Verordnung (EU) Nr. 432/2012)
Zu ihrem Vorteil verwenden wir:
VITAMIN B6 liegt in unserem Produkt in seiner aktivierten Form als PYRIDOXAL-5-PHOSPHAT (P5P) vor und baut Homocystein ab.
Gemeinsam verhindern Ademetionin, Hydroxocobalamin, Quatrefolic® und Pyridoxal-5-Phosphat einen Anstieg des Homocystein-Spiegels im Blut und leisten so einen wichtigen Beitrag zur körperlichen und geistigen Gesundheit.
- Zink trägt dazu bei, die Zellen vor oxidativem Stress zu schützen.
(nach der EU-Verordnung Nr. 432/2012)
Oxidativer Stress ist die Hauptursache des Alterns der Zellen.
◊ Studienbeurteilung durch COCHRANE:
Risikoquoten und Effektgrößenberechnungen für Ademetionin im Vergleich zu anderen Antidepressiva zeigen keinen statistisch signifikanten Unterschied. Diese Ergebnisse deuten darauf hin, dass beide Therapien in ihren Wirkungen annähernd gleich sind.
AHRQ Evidence Report Summaries.Rockville.
Hersteller und Vertrieb:
NUGENIS GmbH, c/o LEBENSAFT, Prinz Eugen-Straße 66, A-1040 Wien, Österreich
Ihr Eduard Rappold