Stress beeinflusst über epigenetische Mechanismen die Schlafarchitektur
Neuronaler Stress, nitrosativer Stress und toxischer Zell-Stress stehen über epigenetische Mechanismen in engem Zusammenhang und beeinflussen die Schlaf-Architektur
◊ Ein durch Stresshormone gesteuertes System, die HPA- Achse (Hypothalamus- Hypophysen- Nebennierenrinden- Achse mit ACTH = adrenocorticotrope Hormon, CRH / AV = corticotropin releasing Hormon / Arginin – Vasopressin, GABA = Gammaaminobuttersäure koordiniert Gehirn (Wahrnehmung=Kognition) und Körper (Reaktion=physische Möglichkeit sich der Gefahr zu entziehen).
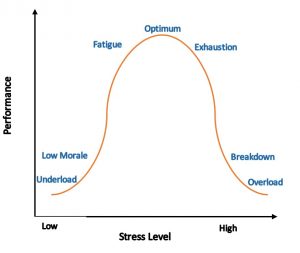
Abb. Die Grafik zeigt die Auswirkung von erhöhtem Stress auf die Leistungsfähigkeit des Körpers. Diese Effekte folgen in Dosis und Zeit einer „umgekehrten U-Form“ -Kurve. Die Zeitleiste zeigt, wie akuter und chronischer Stress und Altern des Gehirns mit der Intensität und Dauer des Stressors interagieren.
◊ Als Hauptquelle auf zellulärer Ebene gilt die endogen Reactive Oxygen Species (ROS) – Produktion der Mitochondrien. Diese Zell-Organellen beherbergen die Komplexe der ATP- produzierenden Atmungskette, weshalb sie auch als Kraftwerke der Zelle bezeichnet werden.
◊ Auf Zellebene kommt noch eine weiteres Stressmoment zu seiner Wirkung, der nitrosative Stress, der durch Spermidinmangel verursacht wird.
Spermidin hemmt die Stickoxidsynthase (NOS). Spermidinmangel fördert die NO-Synthese und verursacht nitrosativen Stress.
In der Peripherie scheint die Polyamin-Stressantwort hauptsächlich von der stressinduzierten Aktivierung der HPA-Achse und von erhöhten zirkulierenden Glucocorticoid-Konzentrationen abhängig zu sein, nicht von der neuronalen Aktivierung. Im Gehirn kann die Polyamin-Stressantwort jedoch unabhängig voneinander durch Glukokortikoide oder durch direkte Aktivierung der neuronalen Schaltkreise induziert werden.
Die langfristige Hemmung der Polyamin(Spermidin)-Synthese verringert die Polyamine im Gehirn und kann zu einer veränderten emotionalen Reaktivität gegenüber Stressoren führen.
Nitrosativer Stress und Schlaf-Architektur
Jeder Gesunde erfährt abends beim Einschlafen einen temporär begrenzten physiologischen nitrosativen Stress. Die Rinde des Vorderhirnes bildet verstärkt neuronales Stickstoffmonoxid (nNO). Dieses blockiert die mitochondriale ATP-Synthese. Laktat, Pyruvat, CrP und ADP steigen an, ATP fällt ab. Dabei wird auch Glutathion oxidiert. Dem Hirn wird die Energiezufuhr gedrosselt, es ermüdet.
Neuronale Stressreaktion und Schlaf-Architektur
Die neuronale Stressreaktion ist kurzfristig anpassungsfähig und vorteilhaft, kann jedoch, wenn sie übermäßig aktiviert wird, zu veränderten Reaktionen auf Stress führen. Eine ständig subjektive Belastung ist mit erhöhten Noradrenalin-, Adrenalin- und Cortisol- Werte verbunden. Es fehlt an einer Relaxationsphase. Die Herzfrequenz und die Blutdruckwerte sind erhöht und die Immunkompetenz ist geschwächt und es hat einen negativen Einfluss auf die Lebenserwartung der Betroffenen. Zunehmende Zahl und Häufigkeit an krankmachenden Stressoren führen zur Alterung des Gehirns.
Das fettlösliche Cortisol kann leicht die Blut-Hirn-Schranke passieren und beeinflusst die Expression zahlreicher Gene, indem Cortisol als sogenannter Transkriptionsfaktor (Bildung von Protein/Enzym am Genort) fungiert.
Cortisol aktiviert die MaoA- und MaoB-Gen – Expression, die als Enzyme für den Abbau der monoaminergen Gehirnbotenstoffe (Dopamin, Serotonin, Adrenalin, Noradrenalin) zuständig sind. Die bei der oxidativen Desaminierung gebildeten toxischen Endprodukte wirken neurotoxisch (Neurodegeneration).
Melatonin-Mangel und Alzheimer-Krankheit (AD)
Melatonin zeigt seine neuroprotektiven Funktionen durch die Blockierung der Aβ-Produktion, Aβ-Oligomerisierung und -Fibrillation, Tau-Hyperphosphorylierung, synaptische Dysfunktion, oxidativen Stress und neuronalen Tod während der AD-Progression.
Apolipoprotein E (ApoE4) und MaoB stehen über der Regulation der Melatonin- Synthese in funktionellem Zusammenhang.
Die toxischen Auswirkungen der Amyloid- Beta- Produktion (zwischen den Neuronen und ihren Synapsen gelegene Beta-Amyloid-Plaques tragen vermutlich zum Zelltod bei) und die Tau-Pathologie (Tau-Tangles führen zu Transportbehinderung innerhalb des Neurons) sind Folgen von oxidativem Stress. Hypomethylation des MaoB- Promotor-Gens (Monoaminooxidase B (MaoB) ist ein Marker im Blut bei Alzheimer- Krankheit und ein erniedrigter MaoB- Level reduziert die β- Amyloid- Produktion) und oxidativer Stress gehen als frühes Ereignis dem Alzheimer- Krankheitsprozess voraus.
Schlafstörungen treten häufig bei der Alzheimerkrankheit auf. Forschungsergebnisse deuten an, dass gestörter Schlaf sogar zum Abbau der Denkleistung und der Entwicklung der Alzheimer-Krankheit beitragen. Schlafstörungen stehen aber auch in engem Zusammenhang mit einer gestörten Funktion der Mitochondrien (mitochondriale Dysfunktion). Die Daten deuten auf einen Beitrag der Mitochondrienstörung zur Schlafstörung bei der Alzheimerkrankheit.
Interessant ist in diesem Zusammenhang das umgangssprachlich als ‚Schlafhormon‘ bezeichnete Melatonin, das wesentlich zur Schlafregulation beiträgt, offenbar auch Veränderungen des Schlaf-Wach-Rhythmus im Verlauf der Alzheimerkrankheit bzw. bei noch leichten Einschränkungen der Denkleistung entgegenwirkt (Cardinali und Kollegen, 2010 im Fachjournal Current Neuropharmacology erschienen) und Schlafstörungen bessert.
Serotonin, Melatonin und Ademetionin haben eine wichtige Rolle bei der Verbesserung der Schlafarchitektur
Serotonin ist der wichtigste Botenstoff im Gehirn. Aus Serotonin wird Melatonin synthetisiert. Melatonin steuert den Tag-Nacht-Rhythmus und hat eine schlaffördernde Wirkung.
Die einzige Möglichkeit den pathologischen Serotoninabbau über die Monoaminooxidase B zu verhindern, ist die Gabe von Ademetionin (S-Adenosylmethionin in seiner stoffwechselaktiven Form). Ademetionin ist zur Synthese des „Timezyme” und für die Biosythese von Spermidin und Spermin essentiell.
Mit dem „Timezyme”, Acetylserotonin-O-Methyltransferase, wird aus Serotonin das N-Acetylserotonin, das mit Hilfe von S-Adenosylmethionin (Ademetionin) methyliert wird und es entsteht Melatonin.
Melatonin steuert den Tag-Nacht-Rhythmus des Menschen und hat einen Anti-Aging-Effekt.
David C. Klein. Arylalkylamine N-Acetyltransferase: “the Timezyme“. JBC Papers, December 12, 2006.
So erklärt sich, dass Melatonin ab dem 6. Lebensjahrzehnt kaum mehr produziert wird, da ja auch die körpereigene Ademetionin-und Spermidin-Produktion ab dem 40. Lebensjahr stark reduziert ist.
Die Produkte der Angewandten Epigenetik von NUGENIS enthalten 400 mg stoffwechselaktives Ademetionin in präventiver Dosierung

Ademetionin ist notwendig für die Melatonin- und Spermidin- de novo Synthese und sichert die Bereitstellung von Serotonin.
Durch Transmethylation verhindert Ademetionin die Glucocorticoid-Rezeptor-Expression, mit Transsulfurierung fördert es die Glutathion-Synthese, durch die Amino-Propylation die Spermidin-Synthese und durch Stummschaltung der Serotoninrezeptor- und Serotonintransporter -Gene wird ausreichend der Neurotransmitter Serotonin in den Synapsen bereitgestellt.
Ihr Eduard Rappold
