Wie altern wir?
Alter ist keine Krankheit. Ist Altern zu verhindern?
Seit Ende des 20. Jahrhunderts gewinnt die Lebenszeitverlängerung in den oberen Altersgruppen an Gewicht. Das wird als Phänomen der Reduzierung der Alterssterblichkeit bezeichnet. Die Wahrscheinlichkeit eines 80-Jährigen, 100 Jahre alt zu werden, ist seit 1950 beispielsweise um das 20-fache gestiegen. Frauen leben länger als Männer.
Auch wenn wir betonen können, dass alt an Jahren nicht gleichbedeutend mit Kranksein ist, nimmt die Wahrscheinlichkeit, an Krankheiten zu leiden, besonders mit dem hohen Alter zu,
Gesundheit im Alter wird durch Lebenslage und Lebensstil beeinflusst. Die subjektive Gesundheit verschlechtert sich beim Altern allerdings weniger als der objektive Gesundheitszustand.
Funktionale Einschränkungen und Aktivitätsbeschränkungen im Alltag aufgrund gesundheitlicher Probleme nehmen mit dem Alter zu. Die Wahrscheinlichkeit für Gesundheitsprobleme – wie etwa Multimorbidität, Pflegebedürftigkeit, Demenz und Depressionen– steigt jenseits des 80. bis 85. Lebensjahrs deutlich an und grenzt unsere Lebensqualität und Lebenserwartung ein. Es ist noch nicht endgültig zu beantworten, ob die Verlängerung der Lebenszeit im Alter auch mit einer Zunahme der Lebensjahre ohne substanzielle funktionale Einschränkungen einhergehen kann. Es überwiegen allerdings die Studien, die Verbesserungen in der funktionalen Gesundheit Älterer in den letzten Jahren nachweisen.
Bis dahin sollten wir uns am Altern erfreuen, denn die gute Nachricht für unsere Lebenszufriedenheit ist:
„Der Gipfel des Unglücks ist mit 49 Jahren erreicht“ (Sebastian Herrmann).
Weniger Stress, weniger Sorgen, weniger Ärger läßt die Lebenszufriedenheit in fortgeschrittenen Jahren eher zunehmen, so berichten Langzeitstudien.
Verschiedene Faktoren beeinflussen Gesundheit im Verlauf des Alterns: Lebensstil und
Gesundheitsverhalten, Lebenssituation und soziale Ungleichheit, medizinische und pflegerische Versorgung sowie gesellschaftliche Rahmenbedingungen und können zu epigenetischen Veränderungen am Erbgut führen und können von uns direkt positiv beeinflußt werden.
Die Alterung des Organismus ist ein komplexer Prozess, der mit einer fortschreitenden Zerstörung der Gewebefunktionalität und einem Verlust der Regenerationsfähigkeit einhergeht. Eines der wichtigsten Alterungsmerkmale ist die Zellalterung, ein stabiler Zustand des Stillstands des Zellzyklus, der als Reaktion auf kumulierten Zellstress und Zellschäden auftritt. Zellalterung ist ein physiologischer Mechanismus, der sowohl positive als auch schädliche Folgen hat.
Die Verlängerung des Lebens war schon immer eines der Ziele der medizinischen Wissenschaft. Wie bereits erwähnt ist die Lebenserwartung in den letzten Jahrzehnten weltweit drastisch gestiegen, was mit erheblichen sozialen und medizinischen Belastungen und Kosten einhergeht. Länger gesund zu bleiben und chronischen Krankheiten vorzubeugen, ist zu essenziellen Themen geworden.
Altersrekordlerinnen
Da sprach der HERR: Mein Geist soll nicht immerdar im Menschen walten, denn er ist Fleisch. Ich will ihm als Lebenszeit hundertzwanzig Jahre geben. 1.Mose 6,3
Jeanne Louise Calment war eine französische Altersrekordlerin. Sie hält seit 1990 den Rekord des höchsten erreichten Lebensalters eines Menschen. Sie war der erste Mensch, der erwiesenermaßen sein 116. sowie die jeweils darauf folgenden Lebensjahre bis einschließlich des 122. vollendete.
Der in der Gegenwart älteste Mensch der Welt, die Japanerin Kane Tanaka, ist im April 2023 im Alter von 119 Jahren gestorben.
Als älteste lebende Frau gilt die Spanierin María Branyas Morera, geboren in den Vereinigten Staaten am 4. März 1907 und heute damit 116 Jahre und 135 Tage alt.
Ernährung, Bewegung und Psychoepigenetik des Sozialverhaltens
Heutzutage versuchen viele Menschen, ihr Leben und ihre Gesundheit mit Diäten (Ernährung), sportlichen Übungen (Bewegung) und guten Gewohnheiten (Empathie, Optimismus, Freundlichkeit) zu verlängern.
US-Forschende veröffentlichten 2022 eine Studie im renommierten Journal of the American Geriatrics Society und erklärten darin, dass eine optimistische Lebenseinstellung die Lebenserwartung von Frauen um bis zu 5,4 Prozent erhöhen kann.
In einer kürzlich publizierte Studie aus den USA kommt zu dem Ergebnis, dass Menschen die regelmäßig in die Kirche gehen eine um 25 Prozent höhere Lebenserwartung und verringerte Entzündungswerte haben.
Der Mensch ist nicht nur ein Einzelwesen, sondern auch ein soziales Wesen. Er ist zugleich Individuum und Teil eines sozialen Kollektivs. Die Individualität eines Menschen steht keineswegs im Gegensatz zur Sozialität. Spezielle Hormone wie Oxytocin und Endorphine ermöglichen bessere soziale Kontakte und diese sind für jeden Menschen enorm wichtig, da sie für ihn einen Großteil des Lebens ausmachen.
Gene werden eingeschaltet, welche Neuropeptide wie Vasopressin oder
Oxytocin produzieren. Ebenso werden Neurotransmitter wie Phenylethlamin, Dopamin oder Serotonin bei sozialem Verhalten über die Monoamin-Oxidasen A und B epigenetisch reguliert.

Das Oxytocin-System ist das wahrscheinlichste biologische Substrat, das der
stresspuffernden Wirkung sozialer Unterstützung zugrunde liegt und hat eine
außergewöhnlich vielfältige Funktion in unserem Körper, vom Regulator
des Geburtsvorgangs hin zum Regulator der Gesellschaft.
Oxytocin stellt die neurohormonelle Basis der individuellen Soziabilität dar, der Fähigkeit, sich in eine Gemeinschaft einzufügen und wirkungsvoll mit anderen zusammenzuarbeiten. Siehe auch PSYCHOEPIGENETIK DES SOZIALVERHALTENS in Eduard Rappold: MITOCHONDRIENGESUNDHEIT, Seite 343 ff.
Der positive Einfluss sozialer Unterstützung auf das Immunsystem konnte bereits in quantitativen Studien gezeigt werden (Boen et al., 2018; Pandey & Shrivastava, 2017). Verschiedene Forschungsergebnisse deuten auf einen negativen Einfluss von allgemeinem und sozialem Distress auf die Immunaktivität hin (Wirtz & Känel, 2017; Yang, Schorpp & Harris, 2014).
Sterblichkeit beginnt bei Vielzellern
Es ist ein Riesensprung in der Geschichte des Lebens: Vor gut 1,2 Milliarden Jahren formen mehrere Zellen einen gemeinsamen Organismus. Einen Vielzeller, weit komplexer als alle anderen Lebewesen zuvor. Damit entstehen die Urahnen aller heutigen Pflanzen und Tiere.
August Weismann stellte 1881 die Hypothese auf, dass Altern und Sterblichkeit erst im Laufe der Evolution vielzelliger Lebewesen auftraten. Beim Einzeller dient die individuelle Zelle gleichzeitig als generative Zelle, die durch die Teilung die Nachfolgegeneration hervorbringt, sodass der ganze einzellige Organismus potentiell unsterblich ist. Beim Vielzeller beschränkt sich diese potentielle Unsterblichkeit auf die generativen Zellen, während der aus den somatischen Zellen aufgebaute, das Individuum definierende, Körper sterblich ist.
Die Kennzeichen des Alterns
Weitgehend unstrittig ist, dass Schäden an Erbsubstanz (DNA, RNA, Histone), Mitochondrien, Zellen und Geweben, die sich mit zunehmendem Alter häufen und vom Körper nicht mehr repariert werden können, für den altersbedingten Funktionsverlust verantwortlich sind. Was diese Schäden auf molekularer Ebene verursacht und warum sie bei jungen, aber nicht bei alten Lebewesen repariert werden können, ist weit weniger klar, aber möglicherweise erklärbar mit der sehr frühen Abnahme der Ademetionin- und Spermidin-Synthese-Leistung.
Vor einigen Jahren noch hielt man die meisten Krankheiten für hauptsächlich genetisch begründet. Große Meta-Studien zeigen, dass 10 bis 30% des Risikos für eine chronische Krankheit vom Genom (vererbbar) determiniert ist, während der Rest im weiteren Sinn durch Umwelteinflüsse (zeitlich begrenzt vererbbar) verursacht wird. Dieses Ergebnis führte man auf Mutationen oder Anomalien der Gene, verursacht durch Karzinogene wie Tabak, Asbest, Benzol, Trichlorethylen, Strahlung und bestimmte Viren zurück.
Heute wissen wir, dass zahlreiche Umweltfaktoren, die für schwere Erkrankungen wie Krebs verantwortlich sind, keine Mutationen verursachen und die DNA- Sequenz nicht beschädigen. Diese Faktoren wirken, indem sie das Epigenom deregulieren und jene epigenetischen Marker verändern, welche die Genaktivität steuern. Sie stehen in Zusammenhang mit den Arbeits- und Lebensbedingungen und den persönlichen Erfahrungen.
Bisherige Schätzungen gehen davon aus, dass genetische Faktoren weniger als
die Hälfte der Varianz bei Krankheiten und Mortalität erklären können.
Diese Erkenntnis veränderte radikal die Sicht auf Krankheiten und eröffnete neue diagnostische und therapeutische Perspektiven und verlangt in der Prävention epigenetisches Wissen um Gesundheit zu sein und zu bleiben. Zum einen ist das Epigenom dynamisch, wodurch epigenetische Veränderungen damit potenziell reversibel sind. Es wäre also möglich, Krankheiten an ihrem epigenetischen Ursprung zu behandeln, indem man die epigenetischen Abweichungen korrigiert, um eine normale Genaktivität wiederherzustellen. Dazu müsste aber die Änderung der individuellen Lebensbedingungen mit krankheitsinduzierenden Gewohnheiten eine wichtige Voraussetzung sein, denn es gibt kein richtiges Leben im falschen.
Wie altern wir?
Zur Beurteilung gilt auch hier eine mehrheitsgestützte Faktenlage gegenüber einer Mainstream-Meinungsbildung zu berücksichtigen.
- Genomische Instabilität
Unser genetisches Material, die DNA, RNA und Histone, wird ständig durch äußere und innere Faktoren geschädigt. Zu diesen schädlichen Faktoren gehören die UV-Strahlung des Sonnenlichts oder reaktive Sauerstoffspezies (ROS), die in unseren Mitochondrien entstehen. Man schätzt, dass unsere DNA täglich bis zu einer Million Mal beschädigt wird. Die meisten dieser Schäden werden sofort repariert, da die Zellen über effiziente Erkennungs- und Reparaturmechanismen verfügen. Diese Reparaturprozesse sind jedoch nicht perfekt, und ein kleiner Prozentsatz der Schäden bleibt unrepariert. Daher häufen sich im Laufe des Alterns die DNA-Schäden an, die verschiedene negative Auswirkungen haben können. DNA-Mutationen erhöhen das Risiko des Tumorwachstums, so dass unser Krebsrisiko mit dem Alter zunimmt. DNA-Schäden können aber auch zu einer verminderten Zellfunktion führen oder die Zellen sogar in die Seneszenz treiben, was zu einer verminderten Organfunktion im Alter beiträgt.
- Verschleiß der Telomere
Telomere sind Schutzkappen an den Enden der Chromosomen, die bei jeder Zellteilung kürzer werden. Werden sie so kurz, dass von ihnen beschützte Gene geschädigt werden könnten, hören die Zellen auf sich zu teilen und zu erneuern. Diese Zellen können dann absterben oder sogar Entzündungen verursachen, die den Alterungsprozess beschleunigen und Krankheiten auslösen.
Als Hayflick-Grenze (englisch Hayflick limit) wird bei Eukaryoten die begrenzte Anzahl von Zellteilungen bezeichnet, denen sich eine Zelle unterziehen kann, bevor der programmierte Zelltod eingeleitet wird, weil die Telomere eine kritische Länge erreicht haben. In jedem Zellverband des menschlichen Körpers finden sich jedoch u. a. Stammzellen, Keimbahn von denen viele nicht von der Hayflick-Grenze beschränkt werden. Sie bilden das Enzym Telomerase oder nutzen andere Mechanismen zur Aufrechterhaltung der Länge der Telomere. Krebszelle weisen eine hohe Aktivität von Telomerase auf und sie hilft ihnen unsterblich zu sein.
- Chronisch-toxischer Stress mit hyperaktiver HPA-Achse
Sind Stressoren ausreichend häufig, stark oder andauernd, wie bei toxischen Stress mit einer überaktiven HPA-Achse, führen sie zu einer Abnutzung des Körpers,
Die Hypothalamus-Hypophysen-Nebennierenachse (hypothalamo-pituitary-adrenal – (HPA) – axis) vermittelt im Wachzustand mit der Ausschüttung von CRH, ACTH und Kortisol humorale Reaktionen des Körpers auf Stressreize.
Das folgende, János Selye, der als Stressforscher Weltruhm erlangte, zugeschriebene Zitat, könnte durchaus auf das Konzept des oxidativen Zellstresses mit überaktiver HPA-Achse zutreffen: „Wenn Stress nur gesehen, isoliert und gemessen werden könnte, bin ich sicher, dass wir die durchschnittliche menschliche Lebensspanne enorm verlängern könnten“.
Für das Gehirn begann 1970 das Gebiet der Neuroendokrinologie mit der
grundlegenden Entdeckung der Kommunikation zwischen Hypothalamus
und Hypophyse durch Geoffrey Wingfield Harris (1913–1971) und bildet
seither die Grundlage für das Verständnis der Gehirn-Körper-Kommunikation über das neuroendokrine System.
1985 begründete der deutsche Arzt Dr. Helmut Sies das Konzept des oxidativen Stresses. Oxidativer Stress mit überaktiver HPA-Achse bezieht sich auf einen Zustand, bei dem der ROS-Belastung die Kapazität der antioxidativen Abwehr durch antioxidative Schutzsysteme in einem biologischen System erheblich überfordert. ROS steht für Reaktive Sauerstoffspezies (Englisch: reactive oxygen species, ROS) – auch vereinfacht als „Sauerstoffradikale“ bezeichnet.
ROS-Verbindungen zeichnen sich insbesondere durch ihre hohe chemische Reaktionsfähigkeit aus und können zur oxidativen Schädigung von DNA, RNA, Proteinen und Lipiden führen. Die Sauerstoffradikale OH• und O2• – sind sehr reaktiv, aber von sehr kurzer Halbwertszeit, und daher in geringerem Ausmaß an einer Zellschädigung beteiligt als das stabilere H2O2.
Der O2•‒ kann durch die Aktivität der Superoxid-Dismutase (SOD) in H2O2
umgewandelt werden.
Mäßiger oxidativer Stress mit aktiver HPA-Achse kann zu Zelldysfunktion
und verändertem Zellverhalten führen (z. B. beschleunigte Seneszenz (Zellalterung), Neurodegeneration, abnormale Proliferation, fehlregulierte Entzündungsreaktionen (Autoimmunität) und Zelltumorgenese), während chronisch-oxidativer Stress mit hyperaktiver HPA-Achse normalerweise Zelltod verursacht (z.B. Onkose, Apoptose und Autophagie).
Beim Menschen ist das Altern mit erhöhten Cortisolspiegeln, einer erhöhten Cortisolproduktion und erhöhten Cortisolreaktionen auf „stressende“ kognitive Herausforderungen verbunden. Diese höheren Cortisolspiegel sind auch mit einem erhöhten kognitiven Verfall bei älteren Menschen verbunden.
Glukokortikoide sind eine Art Steroidhormone. Sie unterdrücken Entzündungen in allen Körpergeweben und steuern den Stoffwechsel in Muskeln, Fett, Leber und Knochen. Glukokortikoide beeinflussen auch den Schlaf-Wach-Rhythmus. Stress beeinträchtigt häufig den Schlaf. Bei chronischem Stress mit hyperaktiver HPA-Achse bleibt der Spiegel des Stresshormons Cortisol auch abends hoch und verhindert somit den erholsamen Schlaf.
DISSTRESS IST NEGATIVER STRESS, DER KRANK MACHT. FÜR SEINE TOXIZITÄT IST DIE URSACHE EINE CHRONISCH ÜBERAKTIVE HPA-ACHSE UND GENERIERT MITOCHONDRIALE DYSFUNKTION:
Die Hypothalamus-Hypophysen-Nebennierenrinden-Achse (HPA-Achse
(hypothalamic-pituitary-adrenal-axis) wird für die Stressanpassung benötigt.
Die Überaktivierung der HPA-Achse verursacht die Sekretion von Cortisol aus der Nebennierenrinde, das auf mehrere Organsysteme einwirkt, um Energieressourcen umzuleiten und den tatsächlichen oder erwarteten erhöhten Bedarf zu decken.
Eine überaktive HPA-Achse fördert jedoch durch die vermehrte Glukokortikoid-Bereitstellung die Monoaminooxidasen- Expression und damit die Generierung der mitochondrialen Dysfunktion (epigenetisch erworbene Mitochondriopathie), denn das aus der Nebennierenrinde freigesetzte Cortisol fördert die MAO B-Expression und verursacht neuerlich chronisch-toxischen Stress mit überaktiver HPA-Stress-Achse durch ROS-Überlastung.
Eine überaktive HPA-Achse liefert den Organismus den eindeutig katabolen Wirkungen von Glukokortikoiden aus und es kommt zum Schaden an wichtigen physiologischen Systemen.
Beispielsweise üben Glukokortikoide ausgeprägte katabole Wirkungen auf hippocampale Neuronen aus und folglich korreliert die Glukokortikoidkonzentration mit der Abnahme der neuronalen Dichte im Hippocampus über die gesamte Lebensdauer. Der Hippocampus ist die Schaltstelle zwischen dem Kurz- und dem Langzeitgedächtnis. Über diese Schaltstelle werden die Inhalte aus dem Kurzzeitgedächtnis – je nach Bedeutung – in das Langzeitgedächtnis übernommen, wo sie gespeichert und bei Bedarf wieder abgerufen werden können.
Die physiologische Bedeutung der Glukokortikoid-Reaktion zeigt eine unzureichende Glukokortikoid-Reaktion unter Bedingungen von ausgeprägtem Stress. Dies führt dazu, dass der Einzelne schlecht auf eine lebensbedrohliche Herausforderung vorbereitet ist. So kann beispielsweise eine niedrige Cortisol-Reaktion auf Stress eine erhöhte Anfälligkeit für die Entwicklung einer Posttraumatische Belastungsstörung (PTBS) voraussagen.
Unser Genom besteht aus mehr als 3 Milliarden Buchstaben, den so genannten Nukleotid-Basen-Paaren, die den Bauplan unseres Körpers codieren. Die Information in der DNA ist jedoch nicht nur in den Basenpaaren gespeichert, sondern auch in chemischen immer aktuell angefügten Veränderungen der DNA und der Histonproteine (epigenetische Werkzeuge). Die Summe dieser epigenetischen – soll heißen „auf dem Gen“ – chemischen Veränderungen wird als Epigenom bezeichnet.
Im Gegensatz zur genetisch codierten Information, die sehr stabil ist, ist das Epigenom sehr dynamisch und verändert sich als Reaktion auf Verhalten, Erfahrungen, Mitwelteinflüsse, Umweltgifte (Schwermetalle, Pestizide, Insektizide, Wohngifte, Putzmittel, Kosmetika), Nanopartikel. Antibiotika und andere Medikamente. Ernährung oder Stress, und die Zelle passt sich so diesen Bedingungen an
Es gibt: EPIGENETISCH WIRKSAME MILIEUS, DIE KRANKMACHENDE DNA- UND HISTON – METHYLIERUNGS-DEFIZITE zur Folge haben,
aber auch EPIGENETISCH WIRKSAME MILIEUS, DIE GESUNDHEITSFÖRDERNDE DNA- UND HISTON – METHYLIERUNGS-SUFFIZITE zeigen.
Das Epigenom verändert sich auch mit dem Alter. In diesem Zusammenhang ist eine bestimmte Modifikation, die so genannte DNA-Methylierung, von Bedeutung.
Unsere DNA trägt Millionen kleiner Methylgruppen, und dieses Muster verändert sich mit dem Alter gewebespezifisch. Die DNA-Methylierung erfolgt durch den physiologischen Methylgruppen-Spender S-Adenosylmethionin (Ademetionin) im Kohlenstoff-1-Zyklus, in dem auch zwei weitere wichtige Syntheseschritte bedient werden: die Spermidin- und die Glutathion-Synthese. Die frühzeitige Abnahme der Syntheseleistung für Ademetionin und Spermidin verursacht DNA-Hypomethylierung, Störung des Autophagieprozesses und subklinische Entwicklung von typischen „Alterskrankheiten“.

Bestimmung des biologischen Alters
Erstaunlicherweise reicht jedoch das DNA-Methylierungsmuster von nur 350 Methylierungsstellen aus, um das biologische Alter eines Menschen vorherzusagen. Diese so genannte epigenetische Uhr ist inzwischen zu einem wichtigen Instrument als Biomarker geworden, siehe EpiAge-Test, mit dessen Hilfe beurteilt werden kann, ob sich eine bestimmte Intervention und Lebenssituation positiv auf die Gesundheit, das Überleben und Lebenspanne des Menschen auswirkt, ohne Jahre oder gar Jahrzehnte warten zu müssen.
Ob Veränderungen der DNA-Methylierung während des Alterns eine ursächliche Rolle spielen, ist noch unklar. Es hat sich jedoch gezeigt, dass Veränderungen in der Modifikation von Histonproteinen die Lebensspanne von Hefe, Würmern und Fliegen beeinflussen, was darauf hindeutet, dass das Epigenom nicht nur als Biomarker dient, sondern auch eine kausale Rolle im Alterungsprozess spielen könnte.
- Verlust der Proteostase
Proteine sind die wichtigsten Moleküle in unseren Zellen. Der Begriff Protein wurde aus dem griechischen Wort Proton für „das Erste, das Wichtigste“ abgeleitet. Sie katalysieren die meisten biochemischen Reaktionen als Enzyme und sind wichtig für die zelluläre Signalübertragung,geben Stabilität als Baumaterial (Muskeln, Organe und Blut) und als freie Aminosäuren in den sogenannten „Aminosäure-Pools“ als Reservespeicher, aus denen dementsprechende Proteine neu nach Bedarf synthetisiert werden.
Damit die Zellen richtig funktionieren können, müssen die Proteine in einem guten Zustand gehalten werden, ein Prozess, der als Proteinhomöostase, kurz Proteostase, bezeichnet wird. Um die Proteostase aufrechtzuerhalten, verfügen Zellen über mehrere Systeme, die die Synthese, die Faltung und den Abbau von Proteinen regulieren. Falsch gefaltete und beschädigte Proteine werden hauptsächlich durch das Proteasom oder über einen Recyclingprozess, die Autophagie, abgebaut.
Endoplasmatischer Retikulum -Stress ist definiert als ein Ungleichgewicht zwischen der Proteinfaltungskapazität und dem Proteinaufkommen im Endoplasmatischen Retikulum, wodurch es zu einer Ansammlung ungefalteter oder fehlgefalteter Proteine kommt.
Als Reaktion auf diesen Zustand versucht die Zelle mit der sogenannten Unfolded Protein Response (UPR) wieder ein Gleichgewicht herzustellen. Dabei soll das Proteinaufkommen im Endoplasmatischen Retikulum gemindert und die Proteinfaltungskapazität des Endoplasmatischen Retikulums erhöht werden. Durch Verminderung der Proteinsynthese und vermehrte Ausschleusung un- und fehlgefalteter Proteine ins Zytosol, gelingt es der Zelle, das Proteinaufkommen im Endoplasmatischen Retikulum zu mindern. Eine Steigerung der Endoplasmatischen Retikulum -Proteinfaltungskapazität erfolgt durch den Anstieg der Synthese molekularer Chaperone und Foldasen. Um einen Verdünnungseffekt zu erzielen, nimmt außerdem das Endoplasmatische Retikulum an Volumen zu.
Ein anhaltender Endoplasmatischer Retikulum -Stress führt zur Apoptose
Endoplasmatischer Retikulum-(ER)-Stress wurde in Zusammenhang mit verschiedenen Erkrankungen gebracht, darunter metabolische Erkrankungen wie Diabetes Mellitus Typ 2 und Insulinresistenz, kardiovaskuläre Erkrankungen wie kardiale Ischämie und kardiale Dekompensation, sowie neurodegenerative Erkrankungen wie Morbus Alzheimer.
Viele Tumorarten wie Gliome, die durch eine schnelle Wachstumsrate, eine erhöhte Proteinsynthese und Hypoxie, hohe Spiegel an ER-Stress aufweisen, nutzen die überlebensfördernden Signale der Unfolded Protein Response. Virale Infektionen wurden ebenfalls in Zusammenhang mit Endoplasmatischem Retikulum -Stress gebracht.
Da un- und fehlgefaltete Proteine ein großes oxidatives Stress- Potential für die Zelle haben, leitet das Mitochondrium bei chronischen Stress mit überaktiver HPA-Stress-Achse die Apoptose ein, wenn die Zelle nicht mehr in der Lage ist, rechtzeitig eine Homöostase wiederherzustellen.
Der Alterungsprozess ist durch einen Verlust der Proteostase gekennzeichnet, was zu einer Anhäufung von geschädigten und nicht funktionsfähigen Proteinen führt [Hipp et al. 2019]. Falsch gefaltete Proteine können verklumpen und Aggregate bilden, ein charakteristisches Merkmal vieler altersbedingter neurodegenerativer Erkrankungen wie Alzheimer (Amyloidopathie) und Parkinson [Hartl 2017].
- Wahrnehmung von Nahrstoffen und regulatorische Schlüsselprodukte im Stoffwechsel
1. Kalorien-Restriktion In einer großen Beobachtungsstudie wurden die Einwohner in Okinawa, Japan untersucht. Man wollte herausfinden, warum die Menschen dort so lange leben. Denn das Besondere an dieser Region ist, dass dort 4- bis 5-mal so viele Hundertjährige leben wie in anderen Industriestaaten.
Während dieser Beobachtungsstudie fand man heraus, dass die Anwohner rund 20% weniger Kalorien zu sich nahmen als im restlichen Japan.
2. Spermidin
Spermidin stabilisiert und erhöht die Proteinsynthese auf das 1,5 bis 2-Fache in den zelleigenen Proteinfabriken, den Ribosomen, und gilt für die Zelle im weiteren als Entsorger und Saubermacher von schädlichen Zellinhalten durch seine Fähigkeit Autophagie zu induzieren.
3. (-)-S-Adenosyl-L-Methionin (Ademetionin)
Quantität und Qualität der Mitochondrien in der Zelle müssen intakt sein, denn Mitochondrien-Gesundheit garantiert Zell-, Organ- und die – Gesundheit des Organismus.
(-)-S-Adenosyl-L-Methionin (Ademetionin)–Mangel führt zur uneingeschränkten Selbstdemontage des Mitochondriums als ATP-liefernde Zellorganelle.
Ohne (-)-S-Adenosyl-L-Methionin (Ademetionin) gibt es keine DNA-Methylierung und keine Langlebigkeit.
4. Silent Information Regulator 2 (SIR2) – Proteine
Silent Information Regulator 2 (SIR2) – Proteine und ihre Verwandten
sind eine Familie von NAD+ -abhängigen Protein-Deacetylasen.
Diese Proteine fördern die Langlebigkeit und spielen eine vielschichtige Rolle im Organismus, Tragen zum Herzschutz bei, indem Entzündungsprozesse gemildert werden und leisten ihren Beitrag zur Langlebigkeit im Zusammenhang als Kalorienrestriktionsmimetikum.
Zellen müssen ihr Wachstum und ihren Stoffwechsel an die Verfügbarkeit von Nährstoffen anpassen. Dazu verfügen sie über so genannte Nährstoffsensorwege, die entweder über Hormone oder über spezifische Nährstoffkomponenten den Nährstoffstatus der Umgebung erfassen und den Zellstoffwechsel entsprechend anpassen.
Der Insulin- und der mTOR Stoffwechselweg bilden zusammen ein zentrales Nährstoffsensornetzwerk in der Zelle, das auch mit den positiven Auswirkungen der Kalorienrestriktion in Verbindung gebracht wird. Interessanterweise verlängert eine genetische oder pharmakologische Hemmung der Signalwege die Lebensspanne bei einer Vielzahl von Tieren, was SIR2 zu einem guten Ziel für die Entwicklung von Anti-Ageing-Medikamenten macht.
- Mitochondriale Fehlfunktion
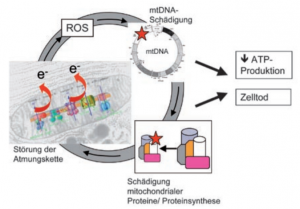
„Sind unsere Mitochondrien gesund, so sind auch wir gesund“ wäre somit das zentrale Dogma für eine gesunde Lebensspanne.
Nach dieser Endosymbiontentheorie entstanden unsere Lebensenergieproduzenten, die Mitochondrien, vor 1,5 Milliarden Jahren durch Endobiose aus einem Alpha-Proteobakterium, das eine eukaryotische Vorläuferzelle inkorporierte und so den Zellen die Energiegewinnung aus Sauerstoff und die Anpassung an die zunehmend sauerstoffreiche Atmosphäre ermöglichte.
Dies war auch die Schlüsselinnovation auf dem Weg zum multizellulären Leben. Es gab nun genügend Energie, um sich den Luxus von Organen mit hohem Energieverbrauch leisten zu können. Die ausdifferenzierten Funktionen unserer Organe Gehirn, Herz, Skelettmuskel, Retina, Leber u.a. wären ohne mitochondrialer Energiebereitstellung undenkbar. Ohne Mitochondrien wären wir in großen Schwierigkeiten, denn es gäbe eine individuelle Energiekrise, die mit dem strukturierten und ausdifferenzierten Leben nicht vereinbar wäre.
Mitochondrien sind im Zentrum des Bioenergetischen Systems
Mitochondrien sind kleine Organellen in der Zelle, die nicht nur „Zellkraftwerke“ sind, sondern auch eine zentrale Schaltstelle für Stoffwechselvorgänge in der Zelle darstellen. Sie erzeugen Energie mit Hilfe von Sauerstoff, ein Prozess, der als mitochondriale Atmung bezeichnet wird.
Die Mitochondrien erzeugen den größten Teil der zellulären Energie, 95% des ATP, durch oxidative Phosphorylierung (OXPHOS) und produzieren die meisten der toxischen reaktiven Sauerstoffspezies (ROS) als Nebenprodukt. Wenn die Abwehrmechanismen der Antioxidantien geschwächt sind, lösen diese reaktiven oxidativen Spezies (ROS) eine Kaskade zerstörerischer Ereignisse im Mitochondrium aus.
Ein wichtiges Merkmal der Mitochondrien ist, dass sie ihre eigene DNA, die so genannte mtDNA, enthalten, die für Proteine kodiert, die für den Atmungskette benötigt werden. Eine wichtige Entdeckung, die die Mitochondrien in den Alterungsprozess einbezieht war, dass Mäuse mit einer hohen Mutationsrate in ihrer mtDNA, so genannte mtDNA-Mutator-Mäuse, eine kurze Lebensdauer haben und Anzeichen einer vorzeitigen Alterung zeigen [Vermulst et al. 2008].
Monoamin Oxidase B-(MAO B)- Expression findet sich im Alter deutlich erhöht
Die MAO B-Expression beim Menschen steigt beim Altern um das 4- bis 5-fache an und führt zu deutlich erhöhter MAO B- Aktivität.
Schon 1997 vermutete JS Fowler: „Die Monoaminooxidase B- (MAO B-)-Aktivität ist im Gehirn alter Menschen deutlich erhöht und es besteht die Vermutung, dass die Monoaminooxidase B (MAO B) eine Rolle im Alterungsprozess spielt“.
Die im Alter erhöhte zerebrale MAO B-Aktivität, wie auch der verminderte Gehalt an reduziertem Glutathion erhöhen den Wasserstoffsuperoxydgehalt und tragen somit zu vermehrtem oxidativen Stress (ROS) bei.
Mitochondrien tragen an der äußeren Mitochondrienmembran auf der Seite zum Intermembranspalt MonoaminOxidase B (MAO B) und MonoaminOxidase A (MAO A), die über oxidative Desaminierung von monoaminergen Neurotransmittern, z.B. Dopamin, Serotonin, Noradrenalin, Adrenalin, das hochreaktive und aggressive Hydroxyl-Radikal •OH produzieren.
Das Hydroxyl-Radikal •OH reagiert mit nahezu allen umgebenden Makromolekülen, wie Lipiden, Proteinen, Desoxyribonukleinsäuren (DNA) und Ribonukleinsäuren (RNA), oxidiert diese Zellstrukturen und führt so zu vielfältigen Zellschäden, einschließlich an den Mitochondrienkomponenten aus Lipiden, Proteinen und DNA, was unverzüglich einen qualitativen und auch quantitativen Schaden der Mitochondrien zur Folge hat.
Dieser quantitative und qualitative Schädigung von Mitochondrien (mitochondriale Dysfunktion) führt zu einem ATP-Mangel, der die ausreichende Bereitstellung von ATP für die de novo-Biosynthese von (-)-S-Adenosyl-L-Methionin (Ademetionin) verhindert und trotz ausreichendem Angebot von L-Methionin die Biosynthese von (-)-S-Adenosyl-L-Methionin (Ademetionin) stark einschränkt.
Die ausreichende Bereitstellung von ATP hängt von der Energieladung (Energieinhalt, energy charge) der Zellorganelle ab und wird als das Verhältnis der einzelnen Adenosinphosphate ATP, ADP und AMP zueinander beschrieben, welches vom physiologischen Zustand der Zellen abhängt. Es regelt direkt oder indirekt die Aktivität der Enzyme, hier am Beispiel der Biosynthese von (-)-S-Adenosyl-L-Methionin aus Methionin und ATP durch das Enzym Methionin-Adenosyl-Transferase.
Eine mitochondriale Dysfunktion findet sich bei vielen neurodegenerativen Erkrankungen, wie Chorea Huntington (HD = Huntington’s disease), Morbus Parkinson (PD = Parkinson’s disease), Alzheimer-Demenz (AD = Alzheimer’s disease), Amyotrophe Lateralsklerose (ALS = amyotrophic late[1]ral sclerosis), Schlaganfall und Epilepsie. Zudem liefern Untersuchungen in den letzten Jahren auch Hinweise für eine Fehlfunktion der Mitochondrien bei psychiatrischen Erkrankungen, wie z.B. Bipolarer Depression (BD) und Major-Depression, sowie bei metabolischen Erkrankungen, wie Diabetes mellitus und Organerkrankungen, wie Herzschwäche im Alter.
OXPHOS – Oxidatives Phosphorilierungssystem ist als „ATMUNGSKETTE“ bekannt
„Wenn es überhaupt so etwas wie den „Lebensfunken“ gibt, dann ist es vielleicht dieser winzige Ladungsfluss durch eine Membran“. Sir Paul Maxime Nurse
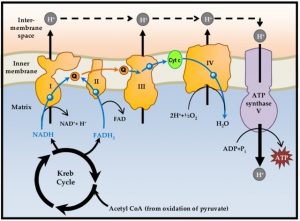
ABB.: SCHEMATISCHE DARSTELLUNG DES MITOCHONDRIALEN OXPHOS SYSTEMS
Quelle: https://www.researchgate.net/publication/276849452_Understanding_Mitochondrial_ DNA_in_Brain_Tumorigenesis
Anordnung der fünf Proteinkomplexe des oxidativen Phosphorylierungssystems (OXPHOS) und das Verhalten des transmembranösen elektrochemischen H+ -Gradienten zur ATP-Synthese
Zusammenfassend zeigt sich, dass die Anordnung der fünf Komplexe des oxidativen Phosphorylierungssystems (OXPHOS) in der inneren Mitochondrienmembran aus hintereinandergeschalteten Proteinkomplexen (I-IV) besteht, entlang derer Elektronen via Redoxreaktionen von den reduzierbaren/oxidierbaren (Redox)-Molekülen der Kette weiter transportiert werden und letztlich am Komplex IV in der mitochondrialen Matrix auf den finalen Elektronenakzeptor Sauerstoff übertragen werden, wodurch dieser zu Wasser (H2O) reduziert wird. Die Elektronen werden dabei von den Reduktionsäquivalenten Nicotinamid-Adenin-Dinukleotid (NADH) und Flavin-Adenin- Dinukleotid (FADH2) bereitgestellt, die die Endprodukte energiegewinnender Stoffwechselwege wie der Glykolyse oder des Abbaus von Fettsäuren darstellen.
Die Reduktion von Sauerstoff zu Wasser ist also in mehrere Teilschritte aufgeteilt. Die dabei schrittweise freiwerdende Energie ermöglicht einen Protonen- = (H+) -Transport an den Komplexen I, III und IV und erzeugt einen transmembranösen elektrochemischen H+ -Gradienten. An einem weiteren Komplex, der ATP-Synthase, folgen die Elektronen ihrem Konzentrationsgradienten und liefern dabei letztlich die Energie zur Synthese von ATP aus Adenosindiphosphat und anorganischem Phosphat.
- Zelltod durch Apoptose für die physiologische Zellbalance
Synonyme: suizidale (nekrotische) Apoptose, „PROGRAMMIERTER ZELLTOD“, „zellulärer Suizid“
Unser Körper besteht aus Hunderten von Zelltypen, die alle von der befruchteten Eizelle stammen. Im Laufe der embryonalen Entwicklung erfolgt ein sehr umfassender Zuwachs der Zellen, die reifen und sich spezialisieren, um die verschiedenen Gewebe und Organe des Körpers zu bilden. Auch bei Erwachsenen entstehen täglich eine Vielzahl von neuen Zellen. Parallel mit
dieser Zellvermehrung erfolgt, sowohl bei dem Embryo als auch bei Erwachsenen, ein Zellsterben als normaler Prozess, um die Zahl der Zellen in den Geweben zu balancieren. Dieses fein abgestimmte, koordinierte Absterben der Zellen nennt man programmiertes Zellsterben.
- Zelluläre Seneszenz
Chronischer Stress mit hyperaktiver HPA-Achse (Cortisol-Belastung) oder die Anhäufung von Schäden im Laufe der Zeit können dazu führen, dass Zellen in einen Zustand eintreten, der als zelluläre Seneszenz bezeichnet wird.
Seneszente Zellen hören auf, sich zu teilen, verlieren ihre ursprüngliche Funktion und beginnen, schädliche Moleküle freizusetzen, darunter entzündliche Zytokine, Wachstumsfaktoren und andere Moleküle. Wichtig ist, dass seneszente Zellen auch die umliegenden Zellen negativ beeinflussen und so zu einer eingeschränkten Organfunktion beitragen.
Es gibt mehrere Auslöser für die zelluläre Seneszenz, darunter die Verkürzung der Telomere, DNA-Schäden, mitochondriale Dysfunktion, Entzündung, oxidativer Stress oder die Aktivierung von Onkogenen.
Wenn eine Zelle seneszent wird, hat dies zwei wesentliche Folgen. Erstens wird ihr Zellzyklus dauerhaft gestoppt. Das bedeutet, dass die Zellen nicht mehr in der Lage sind, sich zu teilen. Darüber hinaus beginnen sie, eine Reihe verschiedener Marker abzusondern, die als „Senescence Associated Secretory Phenotype“(SASP) bezeichnet werden.
Die Sekretion der SASP-Marker schafft eine entzündliche, immunsuppressive Mikroumgebung, die das Tumorwachstum begünstigen kann. Von allen neu diagnostizierten Krebserkrankungen entfallen knapp zwei Drittel auf die 65-Jährigen und Älteren. Tumoren des Darmes und der Lunge sind in dieser Altersgruppe von besonderer Bedeutung.
Welche anderen Krankheiten werden durch das Vorhandensein seneszenter Zellen (SC) im menschlichen Körper begünstigt? Chronische Entzündungen, die durch SASP verursacht werden, können den Alterungsprozess vorantreiben, zusammen mit anderen altersbedingten Krankheiten wie Osteoporose, Gebrechlichkeit, Herz-Kreislauf-Erkrankungen, Osteoarthritis, Lungenfibrose, Nierenerkrankungen, neurodegenerativen Erkrankungen, Lebersteatose und Stoffwechselstörungen.
Seneszente Zellen häufen sich auch während des normalen Alterungsprozesses an, sowohl beim Menschen als auch bei Mäusen. Ein entscheidender Durchbruch in jüngster Zeit war die Entdeckung, dass die Entfernung seneszenter Zellen aus gealterten Mäusen durch genetische oder pharmakologische Behandlung die Gesundheit dieser Tiere verbessert und ihre Lebensspanne verlängert.
Die Entwicklung von Medikamenten, die gezielt seneszente Zellen abtöten, haben erhebliche therapeutische Auswirkungen auf die Verlangsamung von Alterungsphänomenen, die Behandlung altersbedingter Komorbiditäten und die Verbesserung der Resilienz .
im Rahmen der klinischen Studien gewonnenen Daten deuten darauf hin, dass die zelluläre Seneszenz ursächlich an der Entstehung altersbedingter Phänotypen beteiligt ist und dass die Beseitigung seneszenter Zellen Gewebedysfunktionen verhindern oder verzögern und die Lebenserwartung verlängern kann.
Diese als Senolyta benannten Medikamente, töten seneszente Zellen (SC) selektiv ab, ohne dass eine gentechnische Veränderung erforderlich ist. Sie sind in der Lage, die Seneszenz zu erkennen und auf sie einzuwirken, während alle anderen gesunden Zellen unberührt bleiben.
Wie können Senolytika das erreichen?
Häufig weisen seneszente Zellen eine hohe Expression von Genen auf, die die Apoptose unterdrücken, d. h. den Prozess des programmierten Zelltods. Auf diese Weise können sie den Zellzyklus anhalten und sterben nicht ab. Indem sie diese Anti-Apoptose-Proteine hemmen, treiben Senolytika seneszente Zellen in den programmierten Tod. Da diese Proteine nur in der Seneszenz vorhanden sind, bleiben die gesunden Zellen ungestört.
Ein bemerkenswertes Ergebnis wurde mit der Verabreichung der Senolytika Dasatinib und Quercetin bei Patienten mit diabetischer Nierenerkrankung und idiopathischer Lungenerkrankung erzielt, die sich als wirksam erwiesen haben, um die Expression des ausgewählten Biomarkers für Seneszenz, p16(Ink4a) zu verringern.
Es gibt noch eine andere Möglichkeit, Langlebigkeit und Lebensspanne zu erhöhen, indem man auf die Seneszenz abzielt. Während Senolytika die seneszenten Zellen abtöten, zielen idie Senomorphika, nur auf deren schädliche Aspekte ab. Sie reduzieren und begrenzen die entzündliche Wirkung, die durch die Sekretion von SASP verursacht wird. Seneszente Zellen sterben nicht ab, aber sie hören möglicherweise auf, dem Körper zu schaden.
Um dies zu erreichen, hemmen Senomorphika das Protein in der Zelle, das die Expression der SASP-Komponenten steuert. Zwei Beispiele für diese pharmakologischen Wirkstoffe sind Metformin und Rapamycin, wobei ersteres für Typ-2-Diabetes und letzteres für die Immunsuppression zugelassen ist.
Jüngste Erkenntnisse belegen eine gestörte Synthese von bioaktiven Lipiden (Eicosanoiden, Phospholipiden und extrazellulären Vesikeln) ein Teil des seneszenten Phänotyps sind und ihre Eliminierung nachweislich viele altersbedingte Krankheiten und Störungen lindert.
- Erschöpfung der Stammzellen
Die meisten Zellen in unserem Körper verlieren die Fähigkeit, sich zu teilen, wenn sie ihre endgültige Identität erreicht haben, z. B. als Nerven- oder Hautzelle. Daher sind die meisten Organe auf so genannte Stammzellen angewiesen, um Gewebeschäden zu reparieren oder die Gewebeerneuerung zu fördern.
Stammzellen haben die Fähigkeit, sich selbst zu teilen und sich in verschiedene Zelltypen zu differenzieren. Sie spielen eine wichtige Rolle bei der Gesunderhaltung unserer Organe und unseres Körpers.
Das Altern wirkt sich in vielerlei Hinsicht negativ auf Stammzellen aus, und es wird vermutet, dass die Stammzellalterung selbst zur Gewebealterung beiträgt, insbesondere bei Geweben, deren Zellen sich häufig erneuern. Stammzellen können während des Alterns verloren gehen, was zu einer Erschöpfung der Stammzellen und einer verminderten Fähigkeit, Organschäden zu reparieren, führt.
Interessanterweise galt die Alterung von Stammzellen lange Zeit als unumkehrbar, doch neuere Forschungsergebnisse deuten darauf hin, dass es möglich sein könnte, alte Stammzellen zu verjüngen. So konnte gezeigt werden, dass die Injektion von Blutplasma junger Mäuse in alte Mäuse die Stammzellfunktion der alten Tiere verbessert. Die Verjüngung alter Stammzellen könnte daher ein Ansatz sein, um ein gesundes Altern zu ermöglichen.
- Veränderung der interzellulären Kommunikation
Die Zellen und Organe unseres Körpers altern nicht isoliert, sondern kommunizieren über Hormone, Zytokine und Stoffwechselprodukte miteinander. Dass diese interzelluläre Kommunikation eine wichtige Rolle im Alterungsprozess spielt, wurde in Experimenten gezeigt, bei denen der Blutkreislauf von jungen und alten Mäusen miteinander verbunden wurde, ein Ansatz, der als Parabiose bezeichnet wird. Alte Mäuse wurden durch dieses Verfahren teilweise verjüngt, während junge Mäuse Anzeichen einer vorzeitigen Alterung zeigten, was darauf hindeutet, dass es Faktoren im Blut gibt, die zur Alterung des gesamten Organismus beitragen. Darüber hinaus konnte gezeigt werden, dass gezielte lebensverlängernde Eingriffe in einem Gewebe die Alterung in anderen Geweben verzögern und damit die Lebensspanne verlängern können.
- Beeinträchtigte Autophagie
Die Autophagie ist eine Art Recyclingsystem der menschlichen Zelle. Dabei baut der Körper nicht benötigte und kranke Zellbestandteile ab und recycelt sie an anderer Stelle. Es gibt deutliche Hinweise darauf, dass die Autophagie für den Alterungsprozess relevant ist. Studien zeigen, dass beim Menschen die Aktivität von Genen, die an der Autophagie beteiligt sind, mit zunehmendem Alter abnimmt. Außerdem beschleunigt die genetische Hemmung der Autophagie den Alterungsprozess in Modellorganismen. Der Grund dafür könnte eine vermehrte Anhäufung von Proteinen und Zellbestandteilen sein, aber auch die Tatsache, dass Krankheitserreger nicht mehr so gut abgebaut werden können. Es gibt zudem zahlreiche Belege dafür, dass die Stimulierung der Autophagie die Lebenserwartung und Lebensdauer in Modellorganismen erhöht was die Bedeutung der Autophagie für den Alterungsprozess unterstreicht. Spermidin führt zur Induktion des Autophagieprozesses und die Spermidinsynthese bedarf S-Adenosylmethionin.
- Chronische Entzündung
Zunächst löst ein fremder Organismus, ein körperfremder Stoff oder ein Gewebeschaden einen Reiz aus, der das Immunsystem aktiviert. Betroffene oder benachbarte Zellen in der Region um den Entzündungsort ändern dazu ihr Stoffwechselverhalten – meist vermittelt durch den sogenannten Transkriptionsfaktor NF-κB. Sie produzieren nun gezielt bestimmte Proteine und Stoffwechselmodulatoren, die die Entzündungsreaktion einleiten und regulieren.
Das Altern ist durch eine Zunahme von Entzündungen gekennzeichnet, die auch als „Inflammaging“ bezeichnet wird. In jungen Jahren ist die Entzündung normalerweise eine direkte Reaktion auf eine Verletzung und wird abgeschaltet, sobald die Verletzung verheilt ist. In gealterten Geweben kommt es jedoch häufig zu chronischen Entzündungen auf niedrigem Niveau, die Gewebeschäden verursachen und an der Entstehung altersbedingter Erkrankungen wie Fettleibigkeit und Typ-2-Diabetes beteiligt sind. Es konnte gezeigt werden, dass die direkte Beeinflussung der Entzündungswege bei Mäusen zu einer Verjüngung des Gewebes führt und das Überleben positiv beeinflusst.
- Gestörte Darmflora (Dysbiose)
Der menschliche Körper wird von einer Vielzahl von Mikroorganismen wie Bakterien, Pilzen, Protisten und Viren besiedelt, die zusammen als Mikrobiom bezeichnet werden. Man schätzt, dass auf jede menschliche Zelle mindestens eine nichtmenschliche Zelle in unserem Körper kommt.
Mikroorganismen leben auf unserer Haut und in unseren Körperflüssigkeiten, aber die meisten von ihnen befinden sich in unserem Verdauungstrakt und werden daher als Darmmikrobiom bezeichnet. Das Darmmikrobiom hat eine wichtige Funktion für unseren Körper: Mikroorganismen helfen bei der Verdauung von Nahrung, produzieren lebenswichtige Vitamine, prägen unser Immunsystem und helfen bei der Abwehr von Krankheitserregern. Die Zusammensetzung des Darmmikrobioms ist dynamisch und hängt von Umweltfaktoren wie Ernährung oder Stress ab. Zudem verändert sich die Zusammensetzung mit dem Alter.
Während junge, gesunde Menschen ein komplexes Mikrobiom mit vielen verschiedenen Bakterienarten haben, nimmt die Vielfalt mit dem Alter ab, und das Mikrobiom älterer Menschen ist weniger komplex und durch die Anwesenheit von mehr pathogenen Bakterien gekennzeichnet. Interessanterweise finden sich bei sehr alten Menschen, den so genannten Supercentenarians, Mikroben, die normalerweise nur bei jüngeren Menschen vorkommen, was darauf hindeutet, dass sie ein gesünderes Mikrobiom haben. Ob die beobachteten Veränderungen im Darmmikrobiom nur ein Zeichen des Alterns sind oder ob sie ursächlich zum Altern des Menschen beitragen, ist noch eine offene Frage. Jüngste Ergebnisse mit dem Killifisch Nothobranchius furzeri deuten darauf hin, dass das Darmmikrobiom in der Tat eine ursächliche Rolle bei der Alterung spielen könnte. In ihrem Experiment konnten die Forscher zeigen, dass die Übertragung des Darmmikrobioms von jungen auf mittelalte Fische ausreicht, um deren Lebensspanne zu verlängern.
EXKURS: Spermidin das Geheimnis der langen Jugend

Der Nacktmull (Heterocephalus glaber) ist ein mausähnliches Nagetier, das in den Halbwüsten Ostafrikas heimisch ist – vorzugsweise in riesigen unterirdischen Bauten. Die unterirdischen Kolonien können bis zu 300 Tiere zählen. Den geringen Sauerstoffgehalt in den Höhlen kompensieren Nacktmulle vor allem mit ihrem Hämoglobin, das besonders effektiv Sauerstoff ins Blut aufnehmen kann.
Außerdem haben sie eine sehr niedrige Atemfrequenz. Steht gar kein Sauerstoff zur Verfügung, fallen sie in eine Art Starre. Der Nacktmull fährt seinen Puls herunter, im Blut werden Zuckerarten freigesetzt, die Hirn und Herz versorgen.
In diesem Zustand kann er bis zu 18 Minuten ohne Sauerstoff überleben. Sobald die Nacktmull wieder Luft zum Atmen hat, wird der Kreislauf wieder in Gang gebracht und der Nager ist wieder fit.
Auch den stark schwankenden Temperaturen in ihrem Lebensraum haben Nacktmulle einiges entgegenzusetzen: sie können ihre Körpertemperatur zwischen zwölf und 32 Grad Celsius variieren.
Nacktmulle trinken nicht. Flüssigkeit nehmen sie nur über die Nahrung auf, die hauptsächlich aus fasrigen Pflanzenknollen besteht.
Ihre Lebenserwartung ist enorm: Sie leben mindestens 10-mal länger (30-40 Jahre). Zum Vergleich: Hamster, die etwas gleich groß sind, werden im Schnitt nur zwei Jahre alt.
Nacktmulle sind fruchtbar bis zum Lebensende.
Das Geheimnis der langen Jugend: Ihre Zellen altern viel langsamer als die anderen Säugetiere.
Dieser Eigenschaft verdanken sie es auch, dass die kleinen Nager keine Krebserkrankungen bekommen können.
Eine Hypothese bestätigte sich, dass die mit Langlebigkeit verbundenen Stoffwechselveränderungen bei der Nacktmull mit einer bestimmten Darmflora in Zusammenhang steht:
.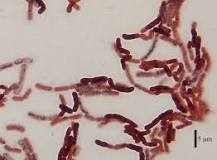
Abb. Bacillus megaterium ist das größte bekannte Bakterium und ist im Darm der Nacktmull (Heterocephalus glaber) für die Spermidin-Biosynthese verantwortlich.
- Altern möglicherweise eine Folge von Ademetionin- und Spermidin-Mangel
S-Adenosylmethionin ist der hauptsächlich Methylgruppen-Spender an die DNA und verhindert eine DNA-Hypomethylierung.
Spermidin induziert die Autophagie und erhöht die Proteinsynthese um das 1,5- bis 2-fache.
Die Bio-Synthese beider Schlüsselmoleküle ist bereits im frühen Erwachsenenalter deutlich vermindert.
Der Körper ist auf Survival ausgelegt mit Stress als seinem Unterstützungssystem.
Wir sind erschöpft und gereizt von Finanzkrise und Inflation, der Migationskrise, geschafft noch von der Coronapandemie, Ukrainekrieg, von Klimakrise auf Dauer und Energienotstand. Wen wundert es, dass der Bürger am Rande des Nervenzusammenbruches steht?
Bei Chronifizierung der Angst-, Panik- und Furchtbelastungen, gestaltet sich die Stressreaktion pathologisch. Auf gesellschaftlicher Ebene kommt es zu Vertrauensverlust und Gereiztheit. Unterstützt wird dieses Verhalten von der bei den Bürgern weitverbreitete individuellen Angst- und Zwangstörung und der Panikmache der Politiker, Lobbyisten und Konzerne und führt zu kollektiven angstgeleiteten Protesten der Bürger und zu einer Spaltung der Gesellschaft.
https://epigenetik.at/angst-furcht-panik-und-epigenetik/
Für Deutschland liegen die Angaben zur Häufigkeit von Angststörungen aus einer großen Bevölkerungsstudie zur Gesundheit Erwachsener vor. Demnach sind in Deutschland etwa 9 von 100 Männern und 21 von 100 Frauen im Alter von 18 bis 79 Jahren innerhalb eines Jahres von einer Angststörung betroffen. 2 – 3 % der Bevölkerung leiden an einer Zwangsstörung. Diese Erkrankung ist bei Frauen und Männern gleich häufig.
Chronischer Stress mit einer erhöhten HPA-Achse setzt Cortisol frei. Cortisol erhöht die Monoamino-Oxidase-Expression am ortsspezifischen hypomethylierten MAO-Gen. Die oxidative Desaminierung von Monaminen führt zum ROS-Boost und ROS verursacht Entzündungsreaktion durch den Angriff auf Großmoleküle (DNA, Proteine, Lipide). Cortisol-Bremse FKBP5 beeinflusst, wie wir auf Stress reagieren. Wenn ein aktuelles Risiko besteht, setzt unsere Nebennierenrinde Cortisol frei. Die eingebaute Bremse verhindert, dass unser Körper dauerhaft mit dem Stresshormon überflutet wird, „beruhigt“ sich aber ziemlich schnell.
Aber: Je aktiver FKBP5 ist, desto schwächer ist diese Bremse.
Traumatische Ereignisse in der frühen Kindheit können dazu führen, dass eine fein abgestimmte Regulierung außer Kontrolle gerät. Untersuchungen zeigen, dass bei einigen missbrauchten Kindern das FKBP5-Gen an bestimmten Positionen weniger methyliert ist, was bedeutet, dass es wahrscheinlich dauerhaft überaktiv ist. Für die Betroffenen führt dies zu einer lang anhaltenden Stressreaktion. Dies wiederum erhöht das Risiko, Angststörungen oder Depressionen zu entwickeln.
Ein Methylgruppen-Angebot an die DNA unterbindet die MAO-Expression und damit die chronische Stressreaktion, Immuninflammation, Mitochondrien- und Zell-Schädigung.
Conclusion
Das Altern ist ein natürlicher und kontinuierlicher Prozess, der im Laufe des Lebens stattfindet. Es gibt verschiedene Aspekte des Alterns, einschließlich des physischen, kognitiven, sozialen und emotionalen Wandels. Hier sind einige wichtige Punkte, um das Altern besser zu verstehen:
- Physisches Altern: Mit zunehmendem Alter kommt es zu Veränderungen im Körper, wie zum Beispiel zum Verlust von Muskelmasse und -kraft, Abnahme der Knochenmineraldichte, Verlangsamung des Stoffwechsels, Veränderungen in der Hautelastizität und Verringerung der sensorischen Fähigkeiten. Diese Veränderungen können zu einer erhöhten Anfälligkeit für Krankheiten und funktionelle Einschränkungen führen.
- Kognitives Altern: Im Laufe des Lebens kann es zu Veränderungen in kognitiven Fähigkeiten kommen, wie zum Beispiel zu einem langsameren Denken, nachlassender Aufmerksamkeit und Gedächtnisproblemen. Es ist jedoch wichtig anzumerken, dass nicht alle kognitiven Funktionen im Alter abnehmen. In einigen Bereichen wie Wortschatz und Lebenserfahrung kann es sogar zu einer Verbesserung kommen.
- Soziales Altern: Das soziale Umfeld und die sozialen Beziehungen spielen eine wichtige Rolle beim Altern. Im Alter kann es zu Veränderungen im sozialen Netzwerk kommen, wie zum Beispiel zum Verlust von Freunden oder Angehörigen. Gleichzeitig können neue soziale Bindungen und Aktivitäten entstehen, die zu einer erhöhten sozialen Unterstützung und Lebenszufriedenheit beitragen können.
- Emotionales Altern: Emotionale Erfahrungen können sich im Laufe des Lebens verändern. Ältere Menschen berichten oft von einer erhöhten emotionalen Stabilität und einer besseren Kontrolle über ihre Emotionen. Gleichzeitig können altersbedingte Veränderungen, wie der Verlust von Selbstständigkeit oder das Nachlassen der körperlichen Gesundheit, emotionale Herausforderungen mit sich bringen.
Wie wir altern, ist von verschiedenen Faktoren abhängig, darunter genetische Veranlagung, Lebensstil, Umweltfaktoren und individuelle Unterschiede. Ein gesunder Lebensstil mit ausgewogener Ernährung, regelmäßiger körperlicher Aktivität, geistiger Stimulation und sozialer Interaktion kann helfen, den Alterungsprozess zu unterstützen und die Lebensqualität im Alter zu verbessern.
Es ist auch wichtig anzumerken, dass Alterszufriedenheit individuell ist und von verschiedenen Faktoren wie persönlichen Einstellungen, Lebenserfahrungen und individuellen Zielen beeinflusst wird. Während einige Menschen mit dem Älterwerden zufrieden und erfüllt sind, können andere Schwierigkeiten und Herausforderungen erfahren. Die Bedeutung von Alterszufriedenheit liegt darin, ein Gleichgewicht zu finden und das Beste aus den gegebenen Umständen zu machen, indem man sich anpassungsfähig und offen für neue Erfahrungen bleibt.
Letztendlich ist das Altern ein natürlicher Bestandteil des Lebens, der sowohl Herausforderungen als auch Chancen mit sich bringt.
Ihr
Eduard Rappold
Literaturangaben auf Anfrage.
EPIGENETIC BRAIN PROTECTOR – EBP®


nugenis.eu/shop

SOJAPULVER aus ÖSTERREICH
MIT HOHEM SPERMIDINGEHALT
mehr als 1,7mg Spermidin pro Esslöffel
Inhalt: 40 Portionen
Hergestellt aus gentechnisch nicht veränderten Sojabohnen (NON GVO <0,1%)
abgefüllt in Membrandosen Ø 99×180
geeignet für: Vegetarier, Veganer, Kosher
SOJAPULVER aus ÖSTERREICH
enthält
SOJA-PROTEIN
enthält essentielle Aminosäuren mit dem idealen Aminosäure-Score von 100
+
SOJA-SPERMIDIN
erhöht die allgemeine Proteinsynthese
um das 1,5- bis 2,0-fache und wirkt gegen den Muskelverlust beim Altern
SOJA-SPERMIDIN induziert die Autophagie und verlängert so die gesunde Lebensdauer der Zellen
spermidine-soyup.com
www.nugenis.eu/shop
Eine „Ernährungswende mit Soja“ bezieht sich auf eine mögliche Veränderung der Ernährungsgewohnheiten in Richtung einer verstärkten Nutzung von Sojaprodukten als Ersatz oder Ergänzung zu herkömmlichen Lebensmitteln tierischen Ursprungs. Die Idee hinter einer solchen Ernährungsumstellung beruht auf verschiedenen Aspekten, die als positiv angesehen werden können:
- Pflanzliche Proteinquelle: Soja ist eine hervorragende pflanzliche Proteinquelle. Es enthält alle neun essentiellen Aminosäuren, die der Körper nicht selbst produzieren kann und daher über die Ernährung aufnehmen muss.
- Cholesterinfrei: Im Gegensatz zu tierischen Proteinquellen ist Soja cholesterinfrei, was es zu einer gesunden Option für diejenigen macht, die ihren Cholesterinspiegel kontrollieren möchten.
- Laktosefrei: Sojaprodukte sind eine gute Alternative für Menschen, die laktoseintolerant sind oder auf Milchprodukte verzichten möchten.
- Umweltverträglichkeit: Der Anbau von Sojabohnen erfordert in der Regel weniger Ressourcen wie Wasser und Land im Vergleich zur Tierhaltung. Eine Ernährung, die mehr auf pflanzlichen Lebensmitteln basiert, kann daher potenziell umweltverträglicher sein.
- Gesundheitliche Vorteile: Sojaprodukte wie Sojapulver, Tofu, Tempeh, Sojamilch und Sojajoghurt enthalten auch andere Nährstoffe wie Ballaststoffe, Vitamine (z. B. B-Vitamine) und Mineralstoffe (z. B. Eisen, Kalzium), die für eine ausgewogene Ernährung wichtig sind.
Soja enthält verschiedene bioaktive Verbindungen, darunter Spermidin und Genistein, die mit potenziellen gesundheitlichen Vorteilen in Verbindung gebracht wurden. Hier sind einige der bekanntesten gesundheitlichen Nutzen von Soja-Spermidin und Soja-Genistein:
- Soja-Spermidin:
- Autophagie-Stimulation: Spermidin ist eine Verbindung, die die Autophagie fördert, einen Prozess, bei dem Zellen ihre eigenen beschädigten oder nicht mehr benötigten Bestandteile abbauen und recyceln. Autophagie spielt eine wichtige Rolle bei der Zellreparatur und dem Schutz vor altersbedingten Krankheiten.
- Längere Lebensdauer: Studien an Modellorganismen wie Hefezellen, Würmern und Fliegen haben gezeigt, dass Spermidin eine lebensverlängernde Wirkung haben kann. Ob diese Wirkung auch beim Menschen besteht, ist jedoch noch nicht vollständig erforscht.
- Herz-Kreislauf-Gesundheit: Spermidin kann positive Auswirkungen auf den Blutdruck und das Lipidprofil haben, was zur Unterstützung der Herz-Kreislauf-Gesundheit beitragen kann.
- Neuroprotektive Wirkung: Es gibt Hinweise darauf, dass Spermidin eine neuroprotektive Wirkung haben kann und bei der Prävention von neurodegenerativen Erkrankungen wie Alzheimer und Parkinson helfen könnte.
- Soja-Genistein:
- Östrogenähnliche Wirkung: Genistein ist ein Phytoöstrogen, das eine ähnliche Struktur wie das weibliche Hormon Östrogen hat. Es kann an Östrogenrezeptoren im Körper binden und eine schwache östrogene Wirkung haben. Dadurch kann Genistein möglicherweise Wechseljahrsbeschwerden mildern und das Risiko für osteoporotische Frakturen verringern.
- Antioxidative Wirkung: Genistein ist ein potentes Antioxidans, das den Körper vor oxidativem Stress und Zellschäden schützen kann.
- Entzündungshemmende Eigenschaften: Genistein kann entzündungshemmende Wirkungen haben, die bei der Bekämpfung von Entzündungen im Körper und der Unterstützung des Immunsystems helfen können.
- Krebsprävention: Es gibt einige Hinweise darauf, dass Genistein eine krebspräventive Wirkung haben kann, insbesondere bei Brust-, Prostata- und Darmkrebs.
