
Schlaf: Epigenetik, das Exposom, Melatonin, Ademetionin und Spermidin
Erholsamer Schlaf/Schlafstörung
Im Schlaf regeneriert sich unser Körper, neu Erlerntes festigt sich und Krankheiten werden abgewehrt. Schlaf kann Stress verarbeiten und ist die Grundlage für einen Tag voller Energie. Neben einer ausgewogenen Ernährung und Bewegung ist erholsamer Schlaf der Schlüssel zu einem körperlich und geistig gesunden Leben.
Lange Einschlafphasen, nächtliches Aufwachen und lange wach liegen, weisen auf auf eine Schlafstörung (Mangel an gesundem Schlaf) hin.
Zusätzlich können sich noch schlafbezogene Atmungsstörungen auf gesunden Schlaf nachteilig auswirken. Eine lange Schlafdauer und ein subjektives Empfinden von nicht erholsamem oder schlechtem Schlaf sind erste Anzeichen für Schlafprobleme.
Was versteht man unter Exposom?
Menschen sind zugleich Produkte einer biologischen und einer kulturellen Evolution (Wolfgang Singer).
Das Wesen des Menschen wird weniger von seinen Genen als durch epigenetisch wirksame Umwelteinflüsse, vornehmlich Erziehung, Sozialisation und Bildung geformt, die wieder selbst kulturabhängig sind.
Der Begriff Exposom wird verwendet, um die Gesamtheit der Exposition mit Umweltgefahren ab der Empfängnis zu beschreiben. Diese Umwelteinflüsse werden mit Änderungen an Metabolitbeständen, Proteinen, RNA-Transkripten und der DNA-Methylierung (internes Exposom: Veränderungen am Epigenom) in Verbindung gesetzt.
Dazu Beispiele:
- die Qualität und Quantität der Ernährung (Ernährung mit Optimierung unseres Methylkapitals nach dem Vorbild der Kreta-Diät, Phytonährstoffe, bis zur kalorienreduzierten „epigenetischen Diät“, Spermidin-Zufuhr als Kalorienrestriktions-Mimetikum),
- Konzept der Gehirn-Darm=Mikrobiom-Achse.
- körperliche Aktivität, die konkrete positive Auswirkungen auf das Epigenom hat, unser
- soziales Milieu, wie Freundschaften und familiäre Beziehungen, und die Art und Weise wie wir aufwachsen, begleitet von mütterlicher Fürsorge oder
- Kindheitstraumata, wie sie verursacht werden durch ein unstrukturiertes Umfeld, prekäre und unstabile Bedingungen und kindlicher Not durch Gewalttätigkeiten,
- Einsamkeit,
- Trauer,
- toxischer Stress, Burnout und Depressionen,
- Störungen des Tagesrhythmus (Jet Lag, Schichtarbeit, Schlafentzug),
- persönlicher Lebensstil, wie zum Beispiel Meditation,
- Abusus von Schadstoffen: Tabak, Alkohol, Drogen,
- Ökotoxikologie, Umweltchemikalien (Pestizide),
- Medikamente wie bei PPI-Langzeiteinnahme und einer Langzeitcortisoltherapie,
- Medikamentenrückstände,
- Lebensmittelkontaminanten, Schimmelpilzgifte, Fremdöstrogene (z.B. Bisphenol A oder Parabene) sowie Pflanzenhormone,
- hässliche, lärmbelastete Nachbarschaft, Mangel an Grünflächen,
- alle haben Auswirkungen, ob sie als „Stress“ oder nicht wahrgenommen werden und verursachen toxischen neuronalen Stress, nitrosativen Stress und letztendlich oxidativen Zellstress über epigenetischer Modulation des Genoms,
- selbst Erfahrungen und Emotionen können ihrerseits in einem epigenetischen Prozess auf die Gene modulierend wirken.
Toxischer neuronaler Stress, nitrosativer Stress und oxdativer Zell-Stress stehen über epigenetische Mechanismen in engem Zusammenhang und beeinflussen die Schlaf-Architektur.
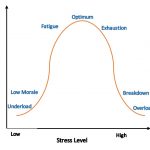
Abb. Die Grafik zeigt die Auswirkung von erhöhtem Stress auf die Leistungsfähigkeit des Körpers. Diese Effekte folgen in Dosis und Zeit einer „umgekehrten U-Form“ -Kurve. Die Zeitleiste zeigt, wie akuter und chronisch-toxischer Stress und Altern des Gehirns mit der Intensität und Dauer des Stressors interagieren.
Neuronale Stressreaktion und Schlaf-Architektur
Die neuronale Stressreaktion ist kurzfristig anpassungsfähig und vorteilhaft, kann jedoch, wenn sie übermäßig und langdauernd aktiviert wird, zu veränderten Reaktionen auf Stress führen. Eine ständig subjektive Belastung ist mit erhöhten Noradrenalin-, Adrenalin- und Cortisol- Werte verbunden. Es fehlt an einer Relaxationsphase. Die Herzfrequenz und die Blutdruckwerte sind erhöht und die Immunkompetenz ist geschwächt und es hat einen negativen Einfluss auf die Lebenserwartung der Betroffenen. Zunehmende Zahl und Häufigkeit an krankmachenden Stressoren führen zur Alterung des Gehirns.
Mit dem Konzept der „Darm-Gehirn-Achse“ wird der Zusammenhang zwischen Darmdysbiose und dem Auftreten bestimmter Pathologien wie z.B. Angstzustände, Depressionen hergestellt. In der Tat wird deutlich, dass bestimmte Pathologien, die mit einem veränderten Mikrobiom verbunden sind, mit Stimmung, Stress, Verhalten und /oder Kognition zusammenhängen. Die Darmmikrobiota ist auch in der Lage, viele Neurotransmitter wie Dopamin, Serotonin, Noradrenalin und δ-Amino-Buttersäuren (GABA) zu synthetisieren, die auch ihre eigenen Wirkungen auf das Gehirn ausüben.
Das fettlösliche Cortisol kann leicht die Blut-Hirn-Schranke passieren und beeinflusst die Expression zahlreicher Gene, indem Cortisol als sogenannter Transkriptionsfaktor (Bildung von Protein/Enzym am Genort) fungiert.

Stress beeinträchtigt häufig auch den Schlaf. Beim chronisch-toxischem Stress bleibt der Spiegel des Stresshormons Cortisol auch abends hoch und verhindert somit den erholsamen Schlaf. Gegen Abend nimmt der Cortisol-Spiegel normalerweise ab und zugleich steigt der Melatonin-Spiegel an. Wichtig ist für den erholsamen Schlaft, dass der Melatonin-Spiegel im Blut vor Mitternacht langsam ansteigt und gegen zwei und drei Uhr früh seinen Höhepunkt erreicht. In den frühen Morgenstunden fällt der Spiegel dann wieder ab, und ungefähr drei Stunden vor dem Aufwachen steigt der Cortisol-Spiegel wieder an, um den Körper auf die Anforderungen des Tages vorzubereiten. Bei chronisch-toxischen Stress ist dieser hormonelle Regelkreis gestört.
Eine überaktive HPA-Achse fördert die Monoaminoxidase-Expression und verursacht toxisch–neuronalen Stress
Cortisol aktiviert die MaoA- und MaoB-Gen – Expression, die als Enzyme für den Abbau der monoaminergen Gehirnbotenstoffe (Dopamin, Serotonin, Adrenalin, Noradrenalin) zuständig sind. Die bei der oxidativen Desaminierung gebildeten toxischen Endprodukte führen zu mitochondrialer Dysfunktion bis zum Verlust des Mitochondriums und letztendlich zum Zelltod. Bei Nerven- und Gliazellen zeigt die progressive Neurodegeneration das Bild der Zerstörung im Gehirn.
Toxisch-neuronaler Stress durch eine überaktive Stress-Achse im Gehirn, HPA-Achse (hypothalamic–pituitary–adrenal- axis) verursacht, spielt ebenfalls eine bedeutende Rolle bei der Generierung von mitochondrialer Dysfunktion bis zum Verlust des Mitochondriums und letztendlichem Zelltod, wie es die progressive Neurodegeneration als Bild der Zerstörung der Gehirnstruktur zeigt, denn Cortisol fördert die MAOB-Expression.
Wo toxisch-neuronaler Stress aktiv ist, geht es immer auch um depressive Symptome, Burnout und Schädigung des Lernzentrums im Gehirn, dem Hippocampus. Chronisch-toxischer Stress gilt entsprechend auch als ein wesentlicher Risikofaktor für die Entwicklung der Alzheimer-Krankheit, kann aber auch eine Folge der Erkrankung sein.
Nitrosativer Stress und Schlaf-Architektur
Auf Zellebene kommt noch eine weiteres Stressmoment zu seiner Wirkung, der nitrosative Stress, der durch Spermidinmangel verursacht ist.
Spermidin hemmt die Stickoxidsynthase (NOS). Spermidinmangel fördert die NO-Synthese und verursacht nitrosativen Stress.
In der Peripherie scheint die Polyamin-Stressantwort hauptsächlich von der stressinduzierten Aktivierung der HPA-Achse (hypothalamic–pituitary–adrenal- axis) und von erhöhten zirkulierenden Glucocorticoid-Konzentrationen abhängig zu sein, nicht von der neuronalen Aktivierung. Im Gehirn kann die Spermidin-Stressantwort jedoch unabhängig voneinander durch Glukokortikoide oder durch direkte Aktivierung der neuronalen Schaltkreise induziert werden.
Experimentelle langfristige Hemmung der Spermidin-Synthese verringert Spermidin im Gehirn und kann zu einer veränderten emotionalen Reaktivität gegenüber Stressoren führen.
Jeder Gesunde erfährt abends beim Einschlafen einen temporär begrenzten physiologischen nitrosativen Stress. Die Rinde des Vorderhirnes bildet verstärkt neuronales Stickstoffmonoxid (nNO). Dieses blockiert die mitochondriale ATP-Synthese. Laktat, Pyruvat, CrP und ADP steigen an, ATP fällt ab. Dabei wird auch Glutathion oxidiert. Dem Gehirn wird die Energiezufuhr gedrosselt, es ermüdet.
Zellulärer Stress wird durch „Reactive Oxygen Species (ROS)” hervorgerufen
Hauptquelle auf zellulärer Ebene gilt die endogen Reactive Oxygen Species (ROS) – Produktion der Mitochondrien. Es sind die toxisch wirkenden Abbauprodukte der Monoamine, die in Membran- oder Lipoproteinnähe zum Angriff auf die Fettsäureseitenketten der Phospholipide führen, als reaktive Stickstoffspezies, Peroxynitrit ONOO− und als reaktive Sauerstoffspezies (Hyperoxid Anion (O2–), Hydroxyl-Radikal (HO·), Peroxylradikal (ROO·), Alkoxylradikal (RO·), Wasserstoffperoxid (H2O2), Hydroperoxid (ROOH), Ozon (O3), Hypochlorit-Anion (OCl−), Singulett-Sauerstoff (1O2)) bekannt.
Serotonin, Melatonin und Ademetionin haben eine wichtige Rolle bei der Verbesserung der Schlafarchitektur
Serotonin ist das phylogenetisch älteste und in allen Teilen des Gehirns wirkende Neurotransmittersystem. Im embryonalen Alter von fünf Wochen entstehen die ersten serotonergen Neurone und beginnen mit der Serotoninsynthese.
Abbildung stammt aus: Mark F. Bear. Neurovegetative und modulatorische Systeme. Neurowissenschaften 2018, pp 559-589.
Ein funktioneller Serotoninmangel, bei normalem Serotonin-Plasmaspiegel, führt zu verminderter chemischen Informationsübertragung an den Rezeptoren der serotoninergen postsynaptischen Membran und steht in Zusammenhang mit Angsterkrankung, Zwangsstörung, toxischem Stress, Burnout und Depression.
Zwei der überzeugendsten biologischen Korrelate von Stimmungsstörungen (Depressionen) sind eine niedrigere Serotonin – Funktion und eine verstärkte Aktivität der Hypothalamus-Hypophysen-Nebennieren- Stress – Achse.
Eine plausible Erklärung ist, dass Umweltstressoren das Serotoninsystem durch epigenetische Prozesse umprogrammieren, indem sie die Genexpression des Serotoninsystems verändern:
◊ durch Stummschaltung der Serotoninrezeptor- und Serotonintransporter -Gene wird ausreichend der Neurotransmitter Serotonin innerhalb der serotoninergen Synapsen bereitgestellt = beeinflusst Angst- und Panik-Reaktionen, Zwangsstörungen, Burnout und Depressionen und
◊ durch die Amino-Propylation die Spermidin-Synthese = fördert die Proteinsynthese und induziert den Autophagieprozess
Serotonin, Dopamin, Noradrenalin und Histamin stehen im Organismus als monoaminerge Botenstoffe zur Verfügung und können ihre Rezeptor-abhängigen Funktionen an den Synapsen optimal erfüllen. Zusätzlich erfüllen diese monoaminergen Botenstoffe auch Rezeptor-unabhängige Funktionen, so wird im Zellkern Einfluss auf die Genexpression der Erbsubstanz (DNA) genommen (Monoaminylierung) – Suchtverhalten wird beispielsweise dadurch günstig beeinflusst. Über die Monoaminylierung wird auch eine Diabetes-Vorsorge möglich, da ein intrazellulärer Serotonin-Mangel in der Bauchspeicheldrüse verhindert wird, was eine reguläre, physiologische Freisetzung von Insulin sicherstellt.
Aus Serotonin wird Melatonin synthetisiert
Ademetionin ist zur Synthese des „Timezyme” und für die Biosythese von Spermidin und Spermin essentiell.
Mit dem „Timezym”, Acetylserotonin-O-Methyltransferase, wird aus Serotonin das N-Acetylserotonin, das mit Hilfe von S-Adenosylmethionin (Ademetionin) methyliert wird und es entsteht Melatonin.
Die einzige Möglichkeit den pathologischen Serotoninabbau über die Monoaminooxidase B zu verhindern, ist die Gabe von Ademetionin (S-Adenosylmethionin) in seiner stoffwechselaktiven Form.
So erklärt sich, dass Melatonin ab dem 6. Lebensjahrzehnt kaum mehr produziert wird, da ja auch die körpereigene Ademetionin-und Spermidin-Produktion ab dem 40. Lebensjahr stark reduziert ist.
Melatonin beeinflusst den Schlaf, exprimiert antioxidative Enzyme und schützt die Gehirnzellen
Melatonin steuert den Tag-Nacht-Rhythmus und hat eine schlaffördernde Wirkung. Es besteht ein robuster Tagesrhythmus der Melatoninsynthese durch die Zellen der Zirbeldrüse. Dies wiederum steuert den Tagesrhythmus des zirkulierenden Melatonins, der durch hohe nachts auftretende Werte gekennzeichnet ist.
Melatonin wird angewendet zur Behandlung von Schlafstörungen (Insomnie). Hier spielt Melatonin eine entscheidende Rolle bei der Hemmung der circadianen Schlafstörung, indem es die Clock-Gene kontrolliert. CLOCK ist ein Gen, das einen grundlegenden Helix-Loop-Helix-PAS-Transkriptionsfaktor codiert, von dem angenommen wird, dass er sowohl die Persistenz als auch die Periode des zirkadianen Rhythmus beeinflusst. Uhrengene sind Bestandteile der circadianen Uhr, vergleichbar mit den Zahnrädern einer mechanischen Uhr.
Die meisten Aspekte der Physiologie und des Verhaltens werden von einem zentralen Uhrmechanismus im Hypothalamus gesteuert. Die Uhr wirkt auf neuronale und endokrine Bahnen, um individuelle zirkadiane Rhythmen zu regulieren, sodass der innere Zustand über 24 Stunden vorhersehbar variiert. Dies ermöglicht die Anpassung an die tägliche und saisonale Umgebung und erhöht die Effizienz durch die zeitliche Trennung von anabolen und katabolen Prozessen.
Durch die Signaltransduktion über aktivierte Melatoninrezeptoren fördert Melatonin außerdem die Expression antioxidativer Enzyme wie Superoxiddismutase, Glutathionperoxidase, Glutathionreduktase und Katalase.
Melatonin zeigt seine neuroprotektiven Funktionen u.a. bei der Alzheimer-Krankheit durch die Blockierung der Aβ-Produktion, Aβ-Oligomerisierung und -Fibrillation, Tau-Hyperphosphorylierung, synaptische Dysfunktion, oxidativen Stress und neuronalen Tod während der AD-Progression.
Melatonin beeinflusst die Neurogenese.
Eine kurze Schlafdauer in der Lebensmitte ist mit einem erhöhten Risiko für eine Alzheimer-Krankheit verbunden
Das Institut national de la santé et de la recherche médicale (Inserm) sowie das University College in London fanden, dass über ein um 30 Prozent höheres Alzheimer- Demenzrisiko im Zusammenhang mit einer Schlafdauer von sechs Stunden oder weniger im Alter von 50 und 60 Jahren im Vergleich zu einer normalen (7 h) Schlafdauer besteht und dass sowohl kurze als auch lange Schlafdauer mit einem erhöhten Risiko für kognitiven Abbau und Demenz verbunden sind.
Diese Längsschnittstudie mit fast 8000 Teilnehmern mit wiederholten Daten zur Schlafdauer und einem langen Follow-up für Demenz deutet darauf hin, dass eine kurze Schlafdauer in der Lebensmitte mit einem erhöhten Risiko für eine Demenzerkrankung verbunden ist.
Auch in einer US-Studie waren fünf Stunden Nachtschlaf und weniger mit einem doppelt so hohen Demenzrisiko verbunden.
Referenzen:
Yaffe, K., Falvey, CM & Hoang, T. Connections between sleep and cognition in older adults. Lancet Neurol. 13 , 1017–1028 (2014) und Liang, Y., Qu, LB & Liu, H. Non-linear associations between sleep duration and the risks of mild cognitive impairment/dementia and cognitive declin. Alternde Clin. Erw. Res 31 , 309–320 (2019).
Chibnik LB, Wolters FJ, Bäckman K, Beiser A, Berr C, Bis JC, Boerwinkle E, Bos D, Brayne C, Dartigues JF, Darweesh SKL, Debette S, Davis-Plourde KL, Dufouil C, Fornage M, Grasset L, Gudnason V, Hadjichrysanthou C, Helmer C, Ikram MA, Ikram MK, Kern S, Kuller LH, Launer L, Lopez OL, Matthews F, Meirelles O, Mosley T, Ower A, Psaty BM, Satizabal CL, Seshadri S, Skoog I, Stephan BCM, Tzourio C, Waziry R, Wong MM, Zettergren A, Hofman A. Trends in the incidence of dementia: design and methods in the Alzheimer Cohorts Consortium. Eur J Epidemiol. 2017 Oct; 32(10):931-938.
Sabia, S., Fayosse, A., Dumurgier, J. et al. Association of sleep duration in middle and old age with incidence of dementia. Nat Commun 12, 2289 (2021).
Robbins R, Quan SF, Weaver MD, Bormes G, Barger LK, Czeisler CA. Examining sleep deficiency and disturbance and their risk for incident dementia and all-cause mortality in older adults across 5 years in the United States. Aging (Albany NY). 2021 Feb 11;13(3):3254-3268.
Das glymphatische System
Als glymphatisches System wird ein Entsorgungssystem für Abfallstoffe im Gehirn und im Rückenmark der Wirbeltiere bezeichnet.
Der Name ist ein Neologismus (Wortneuschöpfung) aus den Begriffen Glia und lymphatisches System und wurde von einer Forschergruppe um Maiken Nedergaard (Rochester und Kopenhagen) 2013 eingeführt, die das glymphatische System erstmals als eine funktionelle Einheit beschrieb.
Ähnlich dem lymphatischen System, das außerhalb der Hirnhaut endet, also nicht im ZNS vorkommt, wird das glymphatische System als ein fließendes Durchlaufsystem zum Abtransport von überflüssigem und schädlichem Material verstanden. Die Transportflüssigkeit wird in das lymphatische System abgegeben.
Das glymphatische System ist ein Netzwerk aus feinsten Röhren, die die Blutgefäße im Gehirn – Arterien und Venen – umgeben.
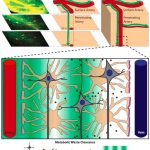
Der Entsorgungsprozess läuft nachts im Tiefschlaf ab. Dann vergrößern sich beim Menschen die Zwischenräume zwischen den Zellen im Gehirn. Die Gehirnflüssigkeit kann hindurchfließen und den „Müll „mit sich hinwegspülen. Mit zunehmendem Alter und bei Schlafmangel sowie oberflächlichem Schlaf arbeitet dieses System der Müllentsorgung allerdings schlechter und begünstigt die Entstehung von neurodegenerativen Erkrankungen.
Melatoninmangel, mitochondriale Dysfunktion und Alzheimer-Krankheit
Melatonin zeigt seine neuroprotektiven Funktionen durch die Blockierung der Aβ-Produktion, Aβ-Oligomerisierung und -Fibrillation, Tau-Hyperphosphorylierung, synaptische Dysfunktion, oxidativen Stress und neuronalen Tod während der Alzheimerkrankheit- Progression.
Apolipoprotein E (ApoE4) und MaoB stehen über der Regulation der Melatonin- Synthese in funktionellem Zusammenhang.
Die toxischen Auswirkungen der Amyloid- Beta- Produktion, zwischen den Neuronen und ihren Synapsen gelegene Beta-Amyloid-Plaques tragen vermutlich zum Zelltod bei, und der Tau-Pathologie, Tau-Tangles führen zu Transportbehinderung innerhalb des Neurons, sind Folgen von oxidativem Stress.
Die Hypomethylation des Monoaminooxidase B (MaoB)- Promotor-Gens durch Ademetionin-Mangel ist ein Marker im Blut bei Alzheimer- Krankheit und ein erniedrigter MaoB- Level reduziert die β- Amyloid- Produktion und oxidativer Stress gehen als frühes Ereignis dem Alzheimer- Krankheitsprozess voraus.
Schlafstörungen treten häufig bei der Alzheimerkrankheit auf. Forschungsergebnisse deuten an, dass gestörter Schlaf sogar zum Abbau der Denkleistung und der Entwicklung der Alzheimer-Krankheit beitragen. Schlafstörungen stehen aber auch in engem Zusammenhang mit einer gestörten Funktion der Mitochondrien (ROS bedingte mitochondriale Dysfunktion). Die Daten deuten auf einen Beitrag der Mitochondrienstörung zur Schlafstörung bei der Alzheimerkrankheit.
Interessant ist in diesem Zusammenhang das umgangssprachlich als ‚Schlafhormon‘ bezeichnete Melatonin, das wesentlich zur Schlafregulation beiträgt, offenbar auch Veränderungen des Schlaf-Wach-Rhythmus im Verlauf der Alzheimerkrankheit bzw. bei noch leichten Einschränkungen der Denkleistung entgegenwirkt (Cardinali und Kollegen, 2010 im Fachjournal Current Neuropharmacology erschienen) und Schlafstörungen bessert.
Weitere Referenzen auf Anfrage erhältlich.
Ihr
Eduard Rappold
NUGENIS PRODUKTE
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
Bestellen Sie bequem in unserem Online Shop
Unsere Produkte enthalten pro Kapsel 400mg Ademetionin (S-Adenosyl-L-Methionin) in der biologisch aktiven (S,S) Form in präventiver Dosierung.
Ademetionin ist der singuläre Methylgruppenspender an unser Erbgut (DNA und Histone) und stärkt in diese einmalige Eigenschaft der Genmethylierug die Zellgesundheit.
SOJAPULVER
mit
SPERMIDIN
und
hochwertigem
SOJAPROTEIN
Spermidin erhöht die allgemeine Proteinsynthese um das 1,5- bis 2,0-fache
und
hochwertiges Sojaprotein stabilisiert Muskelmasse und Muskelkraft und baut so dem altersbedingten Verlust der Skelettmuskulatur vor

40 Portionen
mit
mehr als 1,7mg SPERMIDIN und
mehr als 40 Gramm high quality Sojaprotein
pro Messlöffel
www.spermidine-soyup.com
mit online-shop



