
Herz – Kreislauf – Gesundheit: Spermidin und Protein aus der Sojapflanze
Herz – Kreislauf – Gesundheit:
Spermidin und Protein
aus der Sojapflanze
Die physiologische Funktion des Spermidins in der wachsenden Zelle ist bei der Produktion von Nukleinsäuren und Proteine, bei der Membranstabilisierung wichtig und verzögert dabei Aspekte der Zellalterung
Spermidingabe stabilisiert die Mitochondrienmembranen und die Nukleinsäuren (DNA, RNA)
Spermidin, ein Polyamin, bewirkt an der Mitochondrienmembran eine Stabilisierung durch Neutralisierung der Mitochondrienoberfläche durch eine Verbindung der Polyamine mit den Phospholipiden.
Die Stabilisierung von Nukleinsäuren basiert auf einer Komplexbildung zwischen den basischen Aminogruppen der Polyamine und den sauren Phosphatgruppen der Nukleinsäuren und es kommt zu einer Verstärkung der Sekundärstrukturen wie z.B. DNA-Doppelhelix.
Spermidin spielt eine wichtige Rolle in der Proteinsynthese und fördert das Zellwachstum
Spermidin ist für ein normales Zellwachstum unerlässlich. Spermidin kann die Funktionen von DNA, Nukleotidtriphosphaten, Proteinen und insbesondere RNA modulieren, da die meisten Polyamine (Putrescin, Spermidin und Spermin) in einem RNA- Polyamin- Komplex in den Zellen vorliegen und den Zusammenbau von 30S-ribosomalen Untereinheiten stimulieren und somit die allgemeine Proteinsynthese um das 1,5- bis 2,0 fache erhöhen.
Wechselwirkungen von Polyaminen mit RNA können den Gehalt einzelner Proteine auf vielfältige Weise beeinflussen, einschließlich Änderungen der ribosomalen Struktur, Erleichterung der Bildung von Initiationskomplexen und Ermöglichung des Durchlesens ineffizienter Initiationskomplexe und Verbesserung der Bildverschiebung. Polyamine können den Proteingehalt auch über direkte und indirekte Auswirkungen auf die posttranslationale Proteinverarbeitung und den Proteinabbau beeinflussen.
Polyamine wie Spermidin stimulieren im weiteren die Synthese von 20 verschiedenen Proteinen auf Translationsebene, die stark am Zellwachstum und der Lebensfähigkeit der Zelle beteiligt sind. Die Gene, die für diese 20 verschiedenen Proteine kodieren, werden als „Polyamin-Modulon“ bezeichnet.
Die Wirkungen von Polyaminen auf die Proteinsynthese zeigen eine Rangordnung der Potenz: Spermin < Spermidin < Putrescin. Die wirksame Konzentration von Spermin zur Stimulation der Proteinsynthese beträgt ungefähr nur ein Fünftel der von Spermidin.
Die Erschöpfung von zellulärem Spermidin verursacht einen schnellen Stillstand der Proteinsynthese und des Zellwachstums wird stark eingeschränkt oder gestoppt. Die Aufnahme von exogenen Polyaminen stellt das Zellwachstum wieder her.
eIF5A- und Hypusin-Modifikation sind für die Lebensfähigkeit und das Wachstum der somatischen Zellen unbedingt erforderlich
Spermidin ist der Vorläufer von Hypusin einer ungewöhnlichen Aminosäure, die für die posttranslationale Modifikation benötigt wird und dessen Mangel die Proteinfunktion beeinflusst
Spermidin fungiert als Aminobutylgruppendonor für die posttranslationale Modifikation eines spezifischen Lysinrests des Translationsinitiationsfaktors 5A (eIF5A) durch Desoxyhypusinsynthase.
Der Translationsinitiationsfaktor 5A (eIF5A) spielt eine wichtige Rolle bei der mRNA-Translation, der Zellproliferation, der Zelldifferenzierung und der Entzündung.
Transportersystem für Spermidin
Viele Zellsysteme besitzen in ihrer Zellmembran sowohl allgemeine Transportersysteme für Polyamine als auch einen eigenen Transporter für Spermidin, die den Import von exogenen Polyaminen und Spermidin ermöglichen.
Sojaprotein und essentielle Aminosäuren
Die Sojabohne wird in Asien wegen des hohen Proteingehalts und der hohen Qualität der Aminosäuren im Protein als „Fleisch des Feldes“ bezeichnet. Eine hohe Qualität bedeutet, dass das Sojabohnenprotein alle essentiellen Aminosäuren und damit die erforderliche Menge für die Proteinsynthese im menschlichen Körper bereithält.
Im Vergleich zu Getreide sind Sojaproteine reich an der essentiellen und ernährungsphysiologisch besonders wichtigen Aminosäure Lysin, erforderlich für Modifikationen der Histon-Arme, und von Leucin, wobei generell davon ausgegangen wird, dass eine Leucinanreicherung bei älteren Menschen einen potenziell positiven Effekt auf den Muskelstoffwechsel hat und dass es für diese Wirkung nur eine minimale Dosis braucht. Die Gehalte an den ebenfalls essentiellen schwefelhältigen Aminosäuren Methionin und Cystein sind niedriger als in Getreide. An freien Aminosäuren liegt vor allem Arginin im Sojaprotein vor, daneben sind dies auch Phenylalanin, Valin, Asparagin, Glutaminsäure und Asparaginsäure.
Sojaprotein hat eine anti-atherosklerotische Wirkung und mindert das Risiko für Herzerkrankungen
Mit der täglichen Einnahme von hochwertigem Sojaprotein mit seiner anti-atherosklerotischen Wirkung wird das Risiko für Herzerkrankungen vermindert.
Die Verringerung der Serumtriglyceride ist als eine der gesundheitlichen Auswirkungen von Sojabohnen bekannt und viele Studien haben berichtet und vorgeschlagen, dass die Wirkung auf die ß-Conglycininfraktion zurückzuführen ist.
Die US-amerikanischen Arzneimittelbehörde, die Food and Drug Administration (FDA), genehmigte 1999 eine gesundheitsbezogene Angabe für Sojaprotein, wonach “25 Gramm Sojaprotein pro Tag als Teil einer Diät mit niedrigem Gehalt an gesättigten Fettsäuren und Cholesterin das Risiko für Herzerkrankungen verringern können”.
Die American Heart Association befürwortet, dass der Verzehr von Lebensmitteln, die Sojaprotein enthalten, um Lebensmittel mit hohem tierischen Fettgehalt zu ersetzen, sich für die Herzgesundheit als vorteilhaft erweisen kann.
Kürzlich hat die American Heart Association ihre Position zur Rolle von Sojaprotein für die kardiovaskuläre Gesundheit überarbeitet. Der Bericht analysierte Studien, die die cholesterinsenkende Wirkung von Sojaprotein mit Milchprotein, Weizenprotein und anderen tierischen Proteinen verglichen. Der durchschnittliche LDL- Cholesterin-senkende Nutzen von Soja betrug etwa 3 Prozent, was viel niedriger war als erwartet (frühere Untersuchungen ergaben eine Reduzierung um 8 Prozent). Obwohl Sojaprotein einen geringen Einfluss auf das LDL-Cholesterin (einen primären Risikofaktor für die Entwicklung von Herz-Kreislauf-Erkrankungen) zu haben scheint, hat es dennoch eine Reihe von Vorteilen für die kardiovaskuläre Gesundheit.
Untersuchungen haben gezeigt, dass die Aufnahme von mehr pflanzlichem Protein in der Ernährung im Gegensatz zu mehr Kohlenhydraten klare kardiovaskuläre Vorteile hat, wie z. B. eine Senkung des Blutdrucks.
Soja-Lebensmittel sind von Natur aus cholesterinfrei und arm an gesättigten Fettsäuren.
Soja-Lebensmittel enthalten Omega-3-Fette, essentielle mehrfach ungesättigte Fette. Omega-3-Fette sind mit einem geringeren Risiko für Herz-Kreislauf-Erkrankungen verbunden.
Der Verzehr von Lebensmitteln auf Sojabasis ist eine großartige Möglichkeit, die Ballaststoffaufnahme zu steigern. Ballaststoffe fördern ein gesundes Magen-Darm-System, senken den Cholesterinspiegel und sind mit einem geringeren Risiko für Herz-Kreislauf-Erkrankungen verbunden.
Soja-Lebensmittel sind auch eine großartige Quelle für Vitamine und Mineralstoffe. B-Vitamine, Eisen, Zink und eine Reihe von Antioxidantien runden die ernährungsphysiologischen Eigenschaften von Soja ab.
Sojaprotein hat eine hohe Protein-Qualität und ist leicht verdaulich
Sojabohnen sind eine ausgezeichnete Quelle für hochwertiges Protein, das den meisten anderen Hülsenfrüchten fehlt, was die Sojabohne und ihre Lebensmittel zu einer überlegenen Proteinquelle für Menschen macht, die sich streng vegetarisch ernähren.
Freie Aminosäuren sind die Grundbausteine der Proteinsynthese. Eine hohe Protein-Qualität bedeutet, dass damit alle essentiellen Aminosäuren und damit die erforderliche Menge für die Proteinsynthese im menschlichen Körper bereitgestellt werden. Essentielle Aminosäuren in Sojabohnen erfüllen diese Kriterien vollständig und dies bedingt, dass der Aminosäure-Score von Sojabohnen 100 beträgt.
Der „amino acid score“ (AAS) steht zur ernährungsphysiologischen Beurteilung der Proteinqualität zur Verfügung. Er berücksichtigt den Gehalt der limitierenden Aminosäure im Testprotein, dividiert durch den Gehalt dieser Aminosäure in einem Standardprotein (meist Vollei-Protein bzw. Casein).
Die Quantität der Proteinsynthese hängt von Angebot der unzureichendsten Aminosäure ab, da diese Aminosäure nicht durch eine andere Aminosäure ersetzt werden kann.
Zusätzlich führte die FDA (die US-amerikanische Food and Drug Administration) 1993 den „Protein Digestibility Corrected Amino Acid Score“ (PDCAAS) ein, der die Verdaulichkeit von Proteinen berücksichtigt, und Sojabohnen markieren darauf den perfekten Score „1,0“. Sojaprotein gilt daher als besonders leicht verdaulich.
Kardioprotektive Wirkungen von Spermidin
Spermidin fördert nachweislich die mitochondriale Zellatmung
Die Verbesserung der mitochondrialen Atmungsaktivität erfolgt vorzugsweise über die Aktivierung von Mitochondrienkomplex I, erhöht die mitochondriale Energieproduktion und die Effizienz der mitochondrialen Energieerzeugung durch Sicherung des Protonengradienten für die ATP-Produktion.
Die Auswirkungen der mitocondrialen Dysfunktion auf das kardiale Altern
Die Aufrechterhaltung der normalen Herzfunktion erfordert einen enormen Energieaufwand, welcher durch die ATP-Produktion in den Mitochondrien gewährleistet wird. Mitochondrien sind daher von großer Bedeutung für das Überleben und für die Funktion von Kardiomyozyten.
Die kardiale Seneszenz geht einher mit einem allgemeinen Rückgang der mitochondrialen Funktion, der Expansion von dysfunktionellen Mitochondrien, der erhöhten Produktion von reaktiven Sauerstoffspezies (ROS), der unterdrückten Mitophagie, einer Form der Autophagozytose, bei der gezielt Mitochondrien abgebaut werden, und der Dysregulation von mitochondrialen Qualitätsprozessen, wie Fusion und Spaltung. Von diesen Prozessen ist die Entstehung von oxidativem Stress als Folge übermäßiger ROS-Bildung das am häufigsten beschriebene Phänomen.
Unter oxidativem Stress wird ein konservierter Schutzmechanismus eingeschaltet. Bei Einwirkung von oxidativem Stress wird die Spermidinsynthese induziert, gefolgt von einer selektiven Expression einer Reihe von Genen, in Abhängigkeit von der Spermidinkonzentration, die am Schutz gegen ROS-Stress und der Reparatur von Schäden beteiligt sind.
Pathophysiologische Anomalien, die zur Entwicklung des metabolischen Syndroms beitragen, umfassen eine beeinträchtigte mitochondriale oxidative Phosphorylierung und mitochondriale Biogenese, eine gedämpfte Insulin-Stoffwechsel-Signalgebung, endotheliale Dysfunktion und damit verbundene myokardiale Funktionsanomalien, die zu einer reduzierten mitochondrialen Biogenese und zur mitochondrialen Dysfunktion führen.
Diese mitochondrialen Anomalien können eine metabolische Kardiomyopathie prädisponieren, die durch eine diastolische Dysfunktion gekennzeichnet ist.
Die kardio-protektive Wirkung von Spermidin steht mit einer verminderten Telomerverkürzung im Kardiomyozyten in Verbindung
Die kardio-protektive Wirkung von Spermidin steht mit einer verminderten Telomerverkürzung im Kardiomyozyten in Verbindung. Telomere schützen die Enden der Chromosomen in unseren Körperzellen vor dem Abbau. Chromosomen sind Träger unserer genetischen Information. Bei jeder Zellteilung verkürzen sich ihre Enden ein Stück. Bei sich nicht mehr teilenden Zellen – wie hier etwa den Herzmuskelzellen – werden die Telomere weiter verkürzt. Unterhalb einer kritischen Länge der Telomere setzt die unumkehrbare Apoptoseeinleitung,der sogenannte programmierte Zelltod, ein.
Spermidin verbesserte die mechanoelastischen Eigenschaften von Kardiomyozyten durch eine erhöhte NO-Produktion
Es zeigte sich, dass bei Spermidingabe eine erhöht die Stickstoffmonoxid (NO) – Produktion erfolgt und eine verbesserte NO-abhängige Endothelfunktion bewirkt.
Eine verbesserte Relaxationsfähigkeit des Herzmuskels und eine verbesserte linksventrikuläre diastolische Funktion geht mit einer gesteigerten NO-sensitiven Phosphorylierung des „elastischen“ Proteins Titin einher.
Titin ist das größte bekannte Protein im menschlichen Körper. Es durchspannt das halbe Sarkomer, die kleinste kontraktile Einheit des Muskels, von der Z-Scheibe bis zur M-Linie.
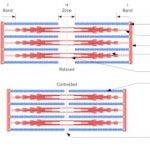
Die I-Bandenregion des Titins übt demnach eine Federfunktion aus, welche die Elastizität des Sarkomers entscheidend mitbestimmt.
Außerdem sorgt Titin für einen optimalen Wirkungsgrad, indem es die dicken Myofilamente im Sarkomer zentriert.
Modulation der passiven Steifigkeit durch Phosphorylierung von Titin
Titin kann durch eine Vielzahl von Proteinkinasen phosphoryliert werden. Als eine der wichtigsten Kinasen für diesen Schritt konnte die Proteinkinase G (PKG) identifiziert werden, was die zentrale Bedeutung des durch Stickstoffmonoxid (NO) mediierten Stoffwechselweges über cyclisches Guanosinmonophosphat (cGMP), ein zellulärer Botenstoff, der für die Weiterleitung von Signalen in der Zelle verantwortlich ist, impliziert, wobei Spermidingabe die Stickstoffmonoxid (NO) – Produktion erhöht,
Konsequenz der Phosphorylierung ist eine Verminderung der durch das kardiale Titin bedingten passiven Steifigkeit (passive Spannung) der Kardiomyozyten .
Oxidativer Stress als Modulator der passiven Steifigkeit von Titin
Oxidativer Stress ist eine Störung im Gleichgewicht zwischen der Produktion von reaktiven Sauerstoff Spezies (ROS) und der Antioxidantien-Abwehr, wie durch die Aktivitäten von Antioxidantien-Scavenger-Enzymen (Superoxiddismutase und Glutathionperoxidase) und alimentäre antioxidative Schutzfaktoren wie Vitamine, Spurenelemente und sekundäre Pflanzenstoffen.
Oxidativer Stress wird z.B. durch myokardiale Ischämie,durch einen Reperfusionsschaden, ein Krankheitsprozess bezeichnet, der durch die wiederhergestellte Durchblutung nach einer mehr oder weniger lang andauernden Minderdurchblutung am Herzen ausgelöst wird, durch Adipositas, Diabetes mellitus oder Alterungsprozesse induziert und moduliert ebenfalls die passive Spannung von Kardiomyozyten und damit die linksventrikuläre diastolische Funktion des Herzens. Oxidativer Stress verringert u.a. die Zugänglichkeit von Stickstoffmonoxid (NO).
Eine durch oxidativen Stress verursachte verminderte Proteinkinase G (PKG) -Aktivität kann letztendlich eine Hypophosphorylierung des Titins bewirken und dadurch zu erhöhter passiver Kardiomyozytenspannung durch Steifigkeit des Titins und dadurch zur diastolischen Dysfunktion führen.
Spermidin und Kreislauf- Gesundheit
Erhöhung der Bioverfügbarkeit von Stickstoffmonoxid (NO) in Endothel und Kardiomyozyten
Im Herzen führt die reduzierte Anzahl an bioaktiver endothelialer Stickstoffmonoxid-Synthase (eNOS) zu verminderter Stickstoffmonoxid (NO)- Produktion und assoziiert dazu zu einer Verschlechterung von Hypertonie-assoziierten pathologischen Veränderungen wie Hypertrophie, Fibrose, Arrhythmien, Myokardinfarkt und Herzversagen. Interessanterweise zeigt sich gleichzeitig bei Hypertonie-Patienten eine verstärkte Expression und Aktivierung der neuronalen Stickstoffmonoxid-Synthase (nNOS) im Myokard. Diese stellt unter anderem über Inhibierung der ROS-Produktion und positive Lusitropie (Steigerung der Relaxationsfähigkeit) eine Art kompensatorischen Schutzmechanismus dar, der das sog. myokardiale Remodeling (Umbauprozess des Myokards) unterdrückt.
Eine erhöhte NO-Produktion in Kardiomyozyten könnte zum einen durch direkte Effekte des Spermidins auf die NOs vermittelt sein. Zum anderen könnten die Effekte aber auch durch eine erhöhte Bioverfügbarkeit von L-Arginin zustande kommen.
Hypothetisch hemmt exogenes zugeführtes Spermidin durch einen negativen Feedback-Mechanismus die endogene Polyaminsynthese und erhöht somit die Bioverfügbarkeit von L-Arginin, welches wiederum als Substrat für die NO- Produktion zur Verfügung steht.
Spermidin senkte den systemischen Blutdruck
Exogene Zufuhr von Spermidin führt durch einen negativen Feedback-Mechanismus zu intrazellulärer Erhöhung der L-Argininkonzentration. Hypothetisch führt diese erhöhte Bioverfügbarkeit des Substrates L-Arginin zu gesteigerter NO-Produktion und Vasodilatation.
Der Verlust der kardialen Makroautophagie (Autophagie) beeinträchtigt die Herzfunktion, und es häufen sich Hinweise darauf, dass ein erhöhter autophagischer Fluss vor kardiovaskulären Erkrankungen schützen kann.
Beim Menschen korreliert eine hohe Spermidinaufnahme mit der Nahrung mit einem verringerten Blutdruck und einem verringerten Risiko für Herz-Kreislauf-Erkrankungen und damit verbundene Todesfälle.
Kardioprotektive Wirkungen von Spermidin durch Förderung des autophagischen Flusses (Autophagie)
Spermidin fördert die Zellgesundheit und Lebensdauer durch Induktion der Autophagie
Spermidin ist ein natürlich vorkommender Autophagie-Induktor als EP300-Inhibitor und erhöht den autophagischen Fluss.
Spermidin unterstützt die Zellen, durch Aktivierung der Autophagie zellbelastendes Material (beschädigte oder überschüssiger Zellorganellen, fehlgefaltete Proteine, Viren und Bakterien) zu entsorgen, entlastet so die Zellen von toxischen Inhalten und trägt zur Zellgesundheit bei.
Die konstitutive Autophagie ist wichtig für die Kontrolle der Qualität von Proteinen und Organellen, um die Zellfunktion aufrechtzuerhalten. Beschädigte Proteine und Zellorganellen reichern sich in gealterten Organen an.
Die autophagische Aktivität wird durch viele Faktoren reguliert, wie den Insulinrezeptor-Signalweg, den mTOR-Weg, Sirt1 und die Kalorieneinschränkung.
Die Hemmung der Autophagie verkürzt die Lebensdauer, und andererseits kann die Induktion der Autophagie die Lebensdauer verlängern.
Spermidin als Inhibitor von Histonacetyltransferasen (HAT) und weitere Inhibitoren von Histon-Acetyltransferasen (HAT’s) wirken als potente Autophagie-Induktoren
EP300: E1A-bindendes Protein p300, eine Lysin-Acetyltransferase,N ( α )-Acetyltransferase 20, auch bekannt als NAT5, katalysiert die N-terminale Acetylierung von Methioninresten.
EP300 wirkt als endogener Repressor der Autophagie. Als potente Autophagie-Induktoren wirken Anacardinsäure, Curcumin, Garcinol einschließlich Spermidin de facto als EP300-Inhibitoren, deacetylieren zelluläre Proteine, hemmen den mTORC1 (Säugetier-Target des Rapamycin-Komplexes 1) – Signalwegs und induzieren die Autophagie.
Zwei Arten von Enzymen, die Histon-Desacetylasen (HDAC) und HistonAcetyltransferasen (HAT) regulieren dabei das Gleichgewicht des Acetylierungsstatus von nukleosomalen Histonen.
Anacardinsäure (isoliert aus Schalen von Cashew Nüssen) ist ein nichtkompetitiver Hemmer von p300 und PCAF-HAT Aktivität.
(Balasubramanyam, K. et al.2003)
Curcumin war der erste p300/CBP-spezifische zelldurchlässige HAT-Inhibitor. Die Kombination von Curcumin mit anderen Derivaten wie Demethoxycurcumin und Bisedethoxycurcumin bildet die Kurkuma. Curcumin aus der Gelbwurz (Curcuma longa) hemmt p300.
(Marcu, M. G. et al. 2006)
Garcinol (isoliert aus der Fruchtrinde von Garcinia indica) hemmt die PCAF- und p300-HAT-Aktivitäten, die mit signifikanten Histon-H3- und H4-Deacetylierungsaktivitäten verbunden sind.
(Balasubramanyam, K. et al. 2004)
Spermidin ist in vitro ein wirksamer Inhibitor von Histonacetyltransferasen.
Heart Failure with preserved Ejection Fraction (HFpEF) als erworbene Mitochondriopathie?
HFpEF ist mit einer sehr schlechten Prognose, häufigen Krankenhausaufenthalten und eingeschränkter Lebensqualität assoziiert. Die 5-Jahres-Überlebensrate liegt bei nur 50 %.
Histon-Deacetylase-Hemmung führte zu einer Verbesserung der kardiopulmonalen und mitochondrialen Funktion in einem präklinischen Modell für HFpEF und zu deutlichen Veränderungen im Azetylierungsmuster an den Genorten von wichtigen mitochondrialen Enzymen.
Es kam durch die Histon-Deacetylase-Hemmung zu einem prozentuellen Anstieg von Typ-1-Skelettmuskelfasern, welche eine höhere oxidative Kapazität aufweisen als Typ-2-Fasern und bei Patienten mit HFpEF reduziert sind.
Als Mechanismus für die verbesserte diastolische Funktion (Relaxation) des Herzens wurde eine neue, nicht-genomische Regulation der myofibrillären Relaxation durch HDAC-Inhibitoren beschrieben.
(Wallner M et al., Sci Transl Med 2020; 12(525). pii: eaay7205)
Spermidin verringert die Herzhypertrophie und sorgt für den Erhalt der diastolischen Funktion
Die häufigsten altersbedingten Veränderungen im Herzen sind Herzhypertrophie (insbesondere am linken Ventrikel), Fibrose und maladaptives Remodelling, die zu diastolischer Dysfunktion und Herzinsuffizienz führen.
Spermidin verbesserte die Lebensfähigkeit von Kardiomyozyten und verringert die Zellnekrosen.
Spermidin übt seine kardioprotektive Wirkungen zumindest durch Förderung des autophagischen Flusses durch Aktivierung des AMPK / mTOR-Signalwegs aus.
Das Niveau der autophagischen Aktivität nimmt mit zunehmendem Alter ab
Das Altern führt zu zahlreichen Veränderungen im menschlichen Herzen auf molekularer, struktureller und funktioneller Ebene. Eine kontinuierliche konstitutive Autophagie während des Alterns spielt aber eine entscheidende Rolle bei der Aufrechterhaltung der Herzstruktur und Herzfunktion.
Immer mehr Anzeichen deuten darauf hin, dass die Autophagie eng mit dem Alterungsprozess des Herzens verbunden ist. Im Alterungsprozess kommt es zu einer Verminderung des Autophagieflusses und dies führt unter anderem ebenfalls zur Akkumulation fehlgefalteter Proteine sowie zu erhöhtem oxidativen Zellstress. Oxidativer Zellstress ist ein bekannter Modulator der Titin-basierten passiven Steifigkeit des Herzmuskels.
Autophagosomen-Biogenese (Membranogenese)
Spermidin ist ein Kalorien- Restriktionsmimetikum und induziert die Autophagosomen-Biogenese (Membranogenese)
Spermidin führt pharmakologisch eine Stoffwechseländerung herbei, die dem Gleichgewicht entspricht, das sich einstellt, wie bei einer Kalorieneinschränkung sobald der Organismus hungert.
Bei Mangel an Nährstoffen (Kalorieneinschränkung) wird Autophagie induziert und läuft verstärkt ab. Von besonderer Bedeutung ist hierbei ein Mangel an Aminosäuren.
Reguliert wird die Autophagie vom mTOR-Komplex. Diese Serin/Threonin-Proteinkinase phosphoryliert eine Vielzahl von Proteinen, darunter auch bestimmte Autophagie-verwandte (ATG)-Proteine.
Die Autophagosomen-Biogenese ist ein dynamisches Membranereignis, das durch die sequentielle Funktion von Autophagie-verwandten (ATG)-Proteinen ausgeführt wird.
ATG-Proteine sind direkt an der Membranlipiddynamik und -organisation während der Autophagie beteiligt.
Die Bildung von Autophagosomen/Autolysosomen kann in fünf verschiedene Schritte unterteilt werden: Initiation, Nukleation, Membranexpansion, Verschluss und Fusion.
Unter nährstoffbegrenzten Bedingungen überleben Zellen, indem sie ihren Zellinhalt abbauen, um die Homöostase, das Energieniveau und die Bausteine aufrechtzuerhalten. Makro-Autophagie (Autophagie) ist ein intrazelluläres Abbausystem, das zytoplasmatische Materialien an das Lysosom/die Vakuole liefert. Als Reaktion auf die Induktion der Autophagie erscheint im Zytoplasma eine becherförmige Membranstruktur, die als Phagophor (auch als Isolationsmembran bekannt) bezeichnet wird. Sobald sich der Phagophor genug verlängert, um seine Substrate aufzunehmen, schließt er sich und dichtet ab, um eine Doppelmembranstruktur zu bilden, die als Autophagosom bezeichnet wird.
Während der Autophagie kommt es zur Zusammenarbeit von ATG-Proteinen (a u t opha g y-bezogen Gene) mit Membranlipiden und direkt mit Membranen zu interagieren, Lipide zwischen Membranen zu übertragen und den Lipidstoffwechsel zu regulieren. Dem endoplasmatischem Retikulum-verwandten Membranen aus dem endoplasmatischen Retikulum der Mitochondrien sollen die primäre Membranquelle sein und als Plattform für die Autophagosomenbildung dienen.
Spermidin wirkt entzündungshemmend
Spermidin und der spermidininduzierte Autophagie-Prozess unterdrücken bestimmte Herzentzündungsparameter und wirken einer subklinischen Entzündung entgegen
Das über die Nahrung aufgenommene Spermidin begünstigt im spezifischen Immunsystem die Ausdifferenzierung der naiven CD4-positiven Immunzellen, so dass vermehrt anti-entzündliche Treg-Zellen gebildet werden. Es kommt gleichzeitig zur Reduktion der Helferzellen TH17, einem Zelltyp, der maßgeblich an Entzündungsreaktionen beteiligt ist. Das Hauptsekretionsprodukt von TH17-Zellen ist das namensgebende IL-17 aus der Zytokin-Familie. Zudem ist die Differenzierung hin zu Treg-Zellen vom Autophagie-Mechanismus abhängig. Der Autophagie-Prozess ist für die Funktionalität der T-Zellen notwendig.
Spermidin induzierte Autophagie hat bei Infektionskrankheiten eine schützende Rolle vor intrazellulären Pathogenen
Viele pathogene Bakterien können in Zellen eindringen und sie intrazellulär besiedeln, um dann auf andere Zellen verteilt zu werden. So ist die Autophagie die einzige Prävention gegen solche intrazellulären Pathogene. Der autophagische Abbau ist somit ein Effektor-Mechanismus der angeborenen und der adaptiven Immunität, der gegen intrazelluläre Mikroben wirkt.
Infektionserreger haben sich in ihrer Evolution darauf spezialisiert, in einem immunkompetenten Wirt zu leben, und sie haben sich dabei verschiedene Habitate erschlossen. Viele Bakterien, Pilze und Parasiten leben bevorzugt im extrazellulären Raum. Auch Viren, die von einer Wirtszelle freigesetzt werden, halten sich kurz dort auf, bevor sie eine neue Zelle infizieren. Wenn Infektionserreger von Phagozyten, wie neutrophilen Granulozyten und Makrophagen aus dem unspezifischen Immunsystem, aufgenommen werden, gelangen sie zunächst in ein Phagosom, wo sie von einer Membran umschlossen sind. Nicht wenige Bakterien und Parasiten können in solchen intrazellulären Vakuolen überdauern und sich sogar darin vermehren. Schließlich gelingt es manchen Erregern, die intrazellulären Vesikel zu zerstören und in das Zytoplasma auszuweichen. Viren versklaven den Stoffwechsel der Wirtszellen für die Produktion viruseigener Proteine, die folglich ebenfalls im Zytoplasma entstehen.
Die neutrophilen Granulozyten hindern die Bakterien im Wachstum, töten sie ab und phagozytieren sie schließlich. Makrophagen haben die Aufgabe, wie es der Name schon verrät, zu phagozytieren und sezernieren Faktoren, die die Entzündungsreaktion steuern.
Streptococcus pyogenes (Streptococcus der Gruppe A) dringt erfolgreich über Endozytose in menschliche Epithelzellen ein. Streptococcus der Gruppe A entweicht sofort aus den Endosomen in das Zytoplasma und gewinnt so eine replikative Nische, danach wird Streptococcus der Gruppe A im Zytoplasma in Autophagosomen-ähnlichen Kompartimenten eingeschlossen und bei Fusion mit Lysosomen abgebaut. Dieser Prozess weist darauf hin, dass die Autophagie eine schützende Rolle bei Infektionskrankheiten spielt.
Auch Staphylococcus aureus induziert seinen autophagischen Abbau. Staphylococcus aureus gilt als die häufigste bakterielle Ursache von Myokarditis und tritt normalerweise im Rahmen einer Bakteriämie und Sepsis auf. Staphylococcus aureus birgt ein großes Gefahrenpotenzial: dieser Erreger ist in Deutschland die Nummer zwei unter den Ursachen schwerer Krankenhausinfektionen bis hin zur Sepsis. Die Koexistenz von Staphylococcus aureus und
dem Menschen wird nur durch eine stete intensive Auseinandersetzung ermöglicht und verursacht hohe immunologische „Kosten“.
Infektionen mit Streptokokken der Gruppe A können manchmal zu Autoimmunkrankheiten führen. Sie werden von den Antikörpern, die gegen die Erreger gebildet wurden, ausgelöst und greifen nun den eigenen Körper an. Es kann dann beispielsweise zu akutem rheumatischem Fieber kommen, das unter Umständen die Herzklappe schädigt (Endokarditis) und ebenso den Herzmuskel (Myokarditis).
Makrophagen räumen nicht nur Zellreste auf, sondern sie beseitigen auch hoch effizient Bakterien und von Viren befallene, durch das Immunsystem zerstörte Zellen. Tatsächlich sind Makrophagen aber auch heimlicher Fluchtort vieler Krankheitserreger, wie Tuberkuloseerreger, aber in den Makrophagen selbst bleiben sie über Jahre sitzen. Genauso wie viele andere intrazelluläre Erreger auch, wie Toxoplasmose, Borrelien u.a.. Auch HIV kann sich in den Makrophagen einnisten. Somit brauchen die Makrophagen einen Mechanismus, um eingeschlossene Erreger wieder los zu werden. Dieser Mechanismus ist der Autophagie-Prozess.
Spermidin verbessert die Immunfunktion
Spermidin reguliert die Selbsttoleranz des Immunsystems und hat antientzündliche Eigenschaften
Mitochondrialer Stoffwechsel und Autophagie sind zwei der stoffwechselaktivsten zellulären Prozesse, die eine entscheidende Rolle bei der Regulierung der Langlebigkeit des Organismus durch Aufrechterhaltung der Zellgesundheit spielen. Somit kommen Ademetionin dem singulären Methylgruppen-Donor für die Erbsubstanz zum Schutz der Mitochondrien vor oxidativer Selbstzerstörung und Spermidin als Autophagie-Induktor für die Gesundheit und Lebenszeit eine ganz zentrale Bedeutung zu.
Spermidin vermehrt die Bildung von anti-entzündliche T-Zellen und reduziert Entzündungszellen.
Spermidin verbessert die Funktion seneszenter menschlicher B-Zellen. B-Zellen sind die einzigen bekannten Antikörper-sekretierenden Zellen im Körper und spielen eine Schlüsselrolle im Kampf gegen Infektionen und für wirksame Impfungen. Die Antikörperreaktionen gegen Krankheitserreger bei alten Personen sind stark beeinträchtigt, wodurch sie sehr anfällig für Infektionskrankheiten sind.
Spermidin steuert die B-Zell-Seneszenz
Die reduzierte Autophagie ist ein zentraler molekularer Mechanismus, der der Immunseneszenz zugrunde liegt.
Die Autophagieniveaus sind in reifen Lymphozyten spezifisch reduziert, was bei alten Menschen zu einer beeinträchtigten Reaktion der Gedächtnis-B-Zellen führt.
Die Supplementation mit Spermidin stellt diesen Weg wieder her und verbessert die Reaktionen alter menschlicher B-Zellen.
Die Autophagie ist ein regulatorischer Mechanismus, der durch eIF5A auf translationaler Ebene vermittelt wird und genutzt werden kann, um die Immunseneszenz beim Menschen umzukehren.
Problem und Lösungen
Der deutliche Anstieg der Monoamino-Oxidase B (MAOB) im Alter um das 3 – 4- fache und der altersabhängige Produktionsrückgang der Biosynthese von Ademetionin und Spermidin sind die Ausgangspunkte für die Genese von toxisch-neuronalem Stress, für erhöhte Cortisolwerte, die die erhöhte Monoamino-Oxidasen (MAOB und MAOA)- Expression verursachen, für den reaktiven Sauerstoffspezies (ROS)-Stress, der die Zellgesundheit mindert und für den ATP-Mangel bei erworbener Mitochondriopathie bedingt durch den vorherrschenden altersabhängigen Ademetionin- und Spermidin-Mangel.
Ein biologisches „Rettungspaket“ aus Ademetionin und Spermidin + hochwertigem Protein aus der Sojapflanze für die Zellgesundheit ist auf dem Weg und auch die Auswirkungen des menschlichen Alterns könnten mit ihm gemildert oder sogar auf eine bestimmte Zeit verzögert werden.
DNA- und Histon-Methylierung sind die Voraussetzung für ein gesundes Altern des Menschen. Dem steht entgegen, ein allgemeiner Verlust der DNA-Methylierung relativ früh bedingt durch einen exposomabhängigen und altersabhängigen Ademetionin-Mangel.
Ohne Ademetionin gibt es keine de novo Spermidin-Synthese
Die körpereigene Ademetionin- und Spermidin- Synthese beim Menschen ist bereits im frühen Erwachsenenalter rückläufig. Das erfordert die regelmäßige Substitution von Ademetionin und Spermidin. Den altersabhängigen Ademetionin- und Spermidin-Mangel auszugleichen, ist so ein wichtiger Teil der Gesundheitsvorsorge und Krankheitsprävention.
Die Biosynthese von Spermidin erfolgt durch Amino-Propylierung im Kohlenstoff 1- Zyklus und für die Biosynthese von Spermidin ist Ademetionin notwendig.
Literaturangaben auf Anfrage erhältlich.
Ihr
Eduard Rappold

ADEMETIONIN in präventiver Dosierung von 400mg, z.B im Epigenetic Brain Protector (EBP), liegt in seiner biologisch aktiven (S;S) Form vor und ist wichtig für die Biosynthese von Spermidin.
SOJAPULVER: 40 Portionen mit mehr als 1,7mg SPERMIDIN und mehr als 40 Gramm high quality Sojaprotein pro Portion