Darm-Mikrobiom: Epigenetik und Spermidin – Konzept der „Darm-Gehirn-Achse“
Das Mikrobiom beeinflusst unsere Gesundheit. Das Mikrobiom eines Menschen, jeder Mensch hat seine ureigene Kombination an Darmbakterien, wird damit zum individuellen Fingerabdruck der Stoffwechselsituation.
Der Darm dient nicht nur der Nahrungsaufnahme, aber die Ernährung verändert die Mikrobiota eines Menschen und beeinflusst das angeborene Immunsystem nachhaltig.
Der GI-Trakt mit einer Oberfläche von 200-300 m2 ist somit der größte „Außenposten“ des Immunsystems und das größte Immunorgan an der Grenze zur Außenwelt.
Das intestinale Immunsystem steht vor der Herausforderung intestinale Pathogene zu erkennen und gleichzeitig die eigene Darmflora oder Antigene der Nahrung zu tolerieren. Dabei trennt nur eine Schicht Enterozyten die Darmflora von den Lymphozyten der Lamina propria. Ein gut funktionierendes Immunsystem ist der Schlüssel zu einer guten Abwehr von pathogenen Organismen. Eine verbesserte Immunantworten zeigt reduzierte Infektionen. Eine Reduzierung des Mikrobioms ist verbunden mit einer Zunahme einer ganzen Reihe von Erkrankungen wie Autoimmun-Erkrankungen, Nahrungsmittelallergien, entzündliche Darmerkrankungen oder Asthma.
Der Darm hat das größte Nervensystem nach dem Gehirn.
Bevor die Natur sich entschied, ein Gehirn, also eine Schaltzentrale für komplexe Organismen zu bauen, waren Verdauungssysteme die ersten Gebilde aus Nervenzellen – kombiniert mit Muskeln, Schleimhäuten und Immunzellen. Vor etwa einer Milliarde Jahren waren das die ersten Organe mit Nervenzellen, die auf die Umwelt reagierten. Und weil die Natur sehr effektiv arbeitet, entschied sie sich, aus genau diesen Nervenzellen Gehirne zu bauen. Die Zusammenarbeit von Gehirn und Darm ist überlebenswichtig. Das zeigt sich bei den Urinstinkten. Stress macht Bauchweh oder stört die regelmäßige Darmentleerung, auch unsere Gefühlswelt ist eng mit unserm Bauch verknüpft.
Das ist auch der Grund, warum wir meist unserem Bauchgefühl folgen, egal wie lange uns ein Problem beschäftigt. Wie eng Kopfhirn und Darmhirn miteinander verwandt und verbunden sind, zeigen Hinweise, dass neurologische und psychische Krankheiten im Darm beginnen bzw. ihren Ursprung haben können.
Der Darm ist Grenze zur Außenwelt und somit kommt einer intakten Darmbarriere mit ihren Schutzebenen allergrößte Bedeutung zu.
Die Schutzebenen des Darmes:
Die Darmbarriere bildet als wichtige physische Schutzbarrieren eine funktionelle Einheit.
Schutzebene 1: Intestinale Mikrobiota (Darmflora)
Schutzebene 2: Darmschleimhaut und bedeckende Schleimschicht
Schutzebene 3: Darm-assoziertes Immunsystem
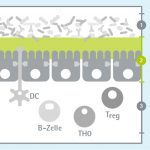
Das Mikrobiom des Darms repräsentiert die Gesamtheit aller mikrobiellen Mitbewohner im Darm, vor allem im Dickdarm. In erster Linie sind hier physiologische bzw. schützende Bakterienspezies gemeint.
Schätzungsweise 90% der im menschlichen Körper gefundenen Zellen sind schließlich nicht menschlich, sondern überwiegend prokaryotischen Ursprungs. So enthält der Darm schätzungsweise 100 Billionen Bakterien, etwa zehnmal so viel wie unser Körper Zellen hat, aus einer mikrobieller Gemeinschaft von 1.000 bis 1.500 Bakterienarten.
Schutzebene 2: Darm-Schleimhaut – aus Mucosazellen mit bedeckender Schleimschicht
Das Darmepithel (Darm-Schleimhaut) ist ein Teil der Darmwand und kleidet die Innenseite des Darms aus. Die Oberfläche des Dünndarms beträgt über 200 m2. Diese Zellschicht spielt eine entscheidende Rolle bei der Aufnahme von Wasser, Elektrolyten und Nährstoffen. Gleichzeitig kontrolliert das Darmepithel als Außengrenze das Eintreten von Bakterien, Viren, Pilzen, Giften und Antigenen, steuert die lokale Immunabwehr und hat damit entscheidenden Einfluss auf die Gesundheit.
Stammzellen sind für den Erhalt und die kontinuierliche Erneuerung der Darm-Mucosazellen essentiell und Spermidin ist für die rasche Zellteilung des Darmepithels verantwortlich.
Durch die Teilung von Stammzellen ist der Darm in der Lage, sich stetig zu regenerieren und während der Lebensdauer des Organismus die Funktion und Integrität der intestinalen Schleimhaut als Schutzebene abzusichern, indem für den Erhalt und die kontinuierliche Erneuerung der Darmzellen gesorgt ist. Diese Aufgaben übernehmen spezialisierte Darmepithelzellen, die alle drei bis fünf Tage aus einem Pool von Darm-Stammzellen neu gebildet werden und alte Mucoszellen ersetzen. Damit ist das Darmepithel das sich am schnellsten erneuernde Gewebe beim Erwachsenen.
Aus einer Stammzelle entsteht wieder eine Stammzelle, die für die Aufrechterhaltung der Funktion wichtig ist und ein Enteroblast, eine Vorläuferzelle, aus der sich dann – je nach vorherrschender Signalkaskade – verschiedene differenzierte Tochterzellen entwickeln können, bekannt als asymmetrische Zellteilung von intestinalen Stammzellen (ISCs). Aus den Enteroblasten entstehen so entweder Enterozyten, die für die Nährstoffgewinnung aus der Nahrung (Resorption), aber auch für die Immunabwehr verantwortlich sind, oder enteroendokrine Zellen, die zur Bildung von Botenstoffen dienen und die Signalvermittlung im Gewebe ermöglichen.
Referenz: Feyerter. Ueber diffuse endokrine epitheliale Organe.Barth, Leipzig 1938; 2., erweiterte Auflage als: Über die peripheren endokrinen (parakrinen) Drüsen des Menschen. Maudrich, Wien 1953.
Der Transkriptionsfaktor Klumpfuss (Klu) , der im Darm die Zelldifferenzierung in unterschiedliche Zelltypen präzise steuert, ist maßgeblich beteiligt.
Klu unterdrückt die Differenzierung der Enteroblasten in enteroendokrine Zellen, indem es die Gene herunterreguliert, die für die enteroendokrine Zell-Differenzierung notwendig sind.
Klu spielt zusammen mit der Notch-Signalisierungskaskade sowohl bei der asymmetrischen Zellteilung von intestinalen Stammzellen (ISCs), als auch bei der Differenzierung der Zellen eine zentrale Rolle.
Bei der Enteroblasten-Differenzierung agiert der Transkriptionsfaktor Klu so, dass er die Expression von Notch-Zielgenen präzise kontrolliert. Der Notch–Signalweg (Notch Signaling) ist ein zentraler Signaltransduktionspfad, der die Zell-Zell-Kommunikation benachbarter Zellen ermöglicht. Die Kontrolle von Notch-Zielgenen durch Klu fügt sich als weitere Regulationsebene in dieses komplexe Zusammenspiel ein, das auch bei vielen Krankheiten des Menschen eine wichtige Rolle spielt. Der Verlust von Notch in ISC-Linien führt zur Bildung von Tumoren. Inzwischen liegt nahe, dass Störungen im Notch-Signalweg verschiedene Krankheiten wie Leukämie, Brustkrebs und Gefäßerkrankungen begünstigen.
Schutzebene 3: Darm-assoziertes Immunsystem in der Submucosa)
Das Gleichgewicht, das zwischen der Mikrobiota (Schutzschicht 1) und dem Wirtsorganismus erreicht wird, ist für die Organisation des Immunsystems von grundlegeder Bedeutung.
Da sich das spezifische Immunsystem (spezifische Immunantwort), das spezifische Erkennen und Unschädlichmachen von in den Körper eingedrungenen Antigenen (Mikroorganismen oder Fremdstoffe) durch das Immunsystem, im Laufe des Lebens mit unterschiedlichsten Pathogenen auseinandersetzt, steigt seine Leistungsfähigkeit mit zunehmendem Alter. Ab der Pubertät ist das erworbene Immunsystem schließlich voll ausgebildet und leistungsfähig. Im höheren Alter steigt die Infektanfälligkeit dann wieder an; gleichzeitig sind Veränderungen hinsichtlich der Zusammensetzung und Funktion einzelner Teile des Immunsystems zu beobachten.
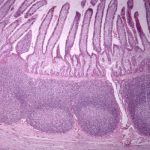
Abb: Peyer-Plaques oder Aggregierte lymphatische Knötchen
Die Peyer–Plaques (Folliculi lymphatici aggregati) sind zusammenhängende Ansammlungen von 10 bis 50 Lymphfollikeln. Sie kommen im gesamten Dünndarm vor, am häufigsten sind sie jedoch im Ileum und im Wurmfortsatz zu finden. Diese Lymphfollikel enthalten B-Lymphocyten vor allem IgA (Immunglobuline) produzierende Zelle. Spezialisierte Epithelzellen (M-Zelle) vermitteln den Transport von IgA in das Darmlumen und den Transport antigener Substanzen – aber auch von Pathogenen aus dem Darmlumen zu den unter dem Epithel gelegenen Antigen-präsentierenden Zellen (Transcytose).
Außer dem Lebensalter, der genetischen Ausstattung wie abweichende Darmmikrobiota in Abhängigkeit des Geschlechts, hat auch der Lebensstil einen entscheidenden Einfluss auf das Immunsystem und die Infektanfälligkeit. Es ist das eigene Verhalten und es sind die äußeren Einflüsse, die die chemischen Veränderungen an der DNA und der Histonproteine eines Organismus beeinflussen und jene Faktoren und Voraussetzungen liefern, die die Aktivität eines Gens lebenslang, dynamisch variabel festlegen.
Darmbakterien produzieren Spermidin
Eine wichtige Gruppe von Stoffwechselprodukten, die je nach Nahrung von den Darmbakterien ausgeschieden werden und anti-entzündliche Eigenschaften aufweisen, sind die sogenannten Polyamine. Zu diesen zählt auch das eng mit dem Zellwachstum verbundene Spermidin.
Durch die Verwertung bestimmter Nahrungsmittel , die große Mengen an Polyaminen bzw. dessen Vorläufer-Molekül L-Arginin enthalten, wie beispielsweise Milchprodukte, Gemüse, Fleisch, Fisch und Sojabohnen, sind die Darmbakterien in der Lage, das Polyamin Spermidin zu produzieren.
Bacteroides und Fusobakterien, zwei numerisch dominante Bakterienpopulationen synthetisieren im Dickdarm, Spermidin und Putrescin. Bakterielle Polyamine werden im Blinddarm und Dickdarm absorbiert. Pektin, ein lösliches unverdauliches Polysaccharid, regt Darmmikroben an, große Mengen an Polyaminen zu synthetisieren (Jutta Noack, 2000).
Referenz: Matsumoto M, Kurihara S, Kibe R, Ashida H, Benno Y. Longevity in mice is promoted by probiotic-induced suppression of colonic senescence dependent on upregulation of gut bacterial polyamine production. PLoS One. 2011;6(8):e23652.
Die regulatorischen T-Zellen, kurz Treg-Zellen, sind eine spezialisierte Untergruppe der T-Lymphozyten, meist CD4+-T-Zellen, die die Selbsttoleranz des Immunsystems regulieren. Selbsttoleranz ist die Fähigkeit des menschlichen Immunsystems, körpereigene Stoffe als solche zu erkennen und von körperfremden Stoffen zu unterscheiden.
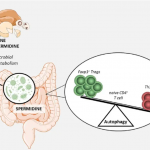
Abb. Die Ernährung hat Einfluss auf das Gleichgewicht der regulatorischen Immunzellen im Darm. Guilhermina M. Carriche / Universitätsmedizin Mainz
Das über die Nahrung aufgenommene Spermidin begünstigt die Ausdifferenzierung der naiven CD4-positiven Immunzellen, so dass vermehrt anti-entzündliche Treg-Zellen gebildet werden. Es kommt gleichzeitig zur Reduktion der TH17-Zellen, einem Zelltyp, der maßgeblich an Entzündungsreaktionen beteiligt ist, Das Hauptsekretionsprodukt von TH17-Zellen ist das namensgebende IL-17 aus der Zytokin-Familie. Zudem ist die Differenzierung hin zu Treg-Zellen vom Autophagie-Mechanismus abhängig. Der Autophagie-Prozess ist für die Funktionalität der T-Zellen notwendig.
Referenz: „Regulating T-cell differentiation through the polyamine spermidine“; Guilhermina M. Carriche et al. Journal of Allergy and Clinical Immunology https://doi.org/10.1016/j.jaci.2020.04.037 (Open Access)
Helferzellen TH17 können im Darm „umprogrammiert“ werden. Sie ändern drastisch ihre Funktion und werden so zu effektiven Helfern bei Immunkrankheiten, beispielsweise Multiple Sklerose oder Rheuma. TH17-Zellen vermitteln einerseits protektive Immunität gegenüber kommensalen Erregern, Kommensale sind Lebewesen, die sich von den Nahrungsrückständen eines Wirtsorganismus ernähren, ohne ihn zu schädigen. TH17-Zellen weisen andererseits Immunpathologie gegenüber pathogen Erregern auf, die beispielsweise ursächlich für die Pathogenese der Parodontitis und der damit verbundener bakterieller Überbesiedlung und der Dysbiose ist.

Abb. Dr. rer. nat. Cornelia Doebis, TH17-Zellen Bedeutung bei chronischen Entzündungen und
Autoimmunerkrankungen, IMD Berlin MVZ
Die mit seiner Langlebigkeit verbundenen Stoffwechselveränderungen stehen beim Nacktmull (Heterocephalus glaber) mit einer bestimmten Darmflora in Zusammenhang.
Abb. Bacillus megaterium ist das größte bekannte Bakterium und ist im Darm vom Nacktmull für die Spermidin-Synthese verantwortlich.
Interaktion mit dem autonomen Nervensystem
Der Vagusnerv ist ein wichtiger, wenn auch anscheinend nicht der einzige Mediator für die Wechselwirkung zwischen Mikrobiota, Darm und Gehirn und hängt möglicherweise vom verwendeten Bakterienstamm ab.
Immunmodulation
Die frühe Besiedlung des Körpers mit verschiedenen Mikroorganismen liefert eine Vielzahl von Antigenen, die für eine angemessene Reifung des Immunsystems entscheidend sind.
Interessanterweise konnte gezeigt werden, dass Darmmikrobiota die Homöostase und die Entzündungsreaktion des Darmepithels in HDAC3-abhängiger Weise (Histondeacetylierung ) modulieren, wodurch ein direkter Zusammenhang zwischen Mikrobiota und epigenetischer Genregulation hergestellt wird. Zunehmende Evidenz zeigt einen signifikanten Beitrag des Immunsignals zur normalen Gehirnfunktion sowie während des Alterns und im Zusammenhang mit neurodegenerativen Erkrankungen.
Histondeacetylase 3 (HDAC3) ist verantwortlich für die Deacetylierung von Lysinresten am N-terminalen Teil der Kernhistone (H2A, H2B, H3 und H4) und einiger anderer Nicht-Histon-Substrate. Die Histondeacetylierung (HDAC3) markiert die epigenetische Repression und spielt eine wichtige Rolle bei der Transkriptionsregulation, dem Zellzyklus und dem Fortschreiten der Entwicklungsereignisse. Die Histondeacetylasen wirken über die Bildung großer Multiproteinkomplexe.
Ein weiterer Mechanismus zur Induktion immunmodulatorischer Effekte bei Störungen der Darm-Gehirn-Achse steht im Zusammenhang mit einer Hypothese des „undichten Darms“ (Leaky Gut Syndrom). In der Tat wurde gezeigt, dass chronischer Stress die Darmbarriere stört, sie undicht macht und die Durchlässigkeit für Ionen und Bakterienpeptide erhöht. Dies deutet indirekt auf eine erhöhte bakterielle Translokation bei stressbedingten psychiatrischen Störungen wie Depressionen hin.
Direkte molekulare Wechselwirkungen mit epigenetischen Machanismen
Mehrere Bakterien können die Transkription ihres Wirts beeinflussen, indem sie Proteineffektoren sekretieren, die endogene Transkriptionsregulatoren des Wirts imitieren und die epigenetische Landschaft der Wirtszellen verändern.
Reizdarmsyndrom und viszerale Schmerzen
Es konnte gezeigt werden, dass ein bekanntes Bakterium ( Staphylococcus aureus ) nozizeptive Neuronen direkt stimuliert, was zur Überlegung führt, ob sie Neurone des autonomen Nervensystems durch ähnliche Mechanismen stimulieren können, was Auswirkungen auf Pathologien haben könnte, die mit viszeralen Schmerzen verbunden sind.
So ist die viszerale Überempfindlichkeit bei das Reizdarmsyndrom ein Kennzeichen für Pathologien der Darm-Gehirn-Achse . Eine Histondeacetylierung-Hemmung bei der Behandlung von stressinduzierten Darmsymptomen wie viszeralen Schmerzen hat einen vorteilhaften Effekt.
Autismus und neurologische Entwicklungsstörungen
Jüngere Erkenntnisse deuten darauf hin, dass Autismus, wenn auch nur in relativ kleinen Kohorten untersucht, mit Veränderungen der Zusammensetzung und des Metabolismus von Mikrobiota assoziiert ist.
Ein gewebespezifischer Transkriptionsfaktor (SETDB1), eine Histon-Lysin-N-Methyltransferase, sorgt für die Genomstabilität
Die Neubildung der spezialisierten Zellen des Darmepithels wird überwiegend durch gewebespezifische Transkriptionsfaktoren gesteuert, deren Zugang zur DNA wiederum davon abhängt, ob DNA relativ frei zugängig ist (Euchromatin) oder eng verpackt vorliegt (Heterochromatin).
Die Genomstabilität beruht auf epigenetischen Mechanismen, die die Unterdrückung endogener Retroviren (ERVs) erzwingen. SETDB1 ist eine Histon-Lysin-N-Methyltransferase, die beim Menschen vom SETDB1- Gen kodiert wird, in der Heterochromatin-Bildung involviert ist und für die Neubildung der Darmepithel-Zellen und die Verhinderung von akuten Darm-Entzündung maßgebend ist. Folgen, die ein Verlust der Histon-Lysin-N-Methyltransferase SETDB1 in den Darm-Stammzellen hat, führt zum massiven Vermehren endogener Retroviren. Sie verursachen DNA-Schäden und Entzündungen und lassen die Zellen letztendlich absterben. Dieser Darmmucosa-Schaden verhindert die Aufnahme von Flüssigkeit und Nährstoffen, ruft eine akute Darmentzündung hervor und führt innerhalb weniger Tage zum Tod des Patienten.
Referenz: Diese Studie wurde durch die TU Dresden / CRTD im Rahmen der deutschen Exzellenzinitiative finanziert und durch das DRESDEN-concept Genom Center und die Elektronen- und Lichtmikroskopie-Facilities der TU Dresden CMCB-Technologieplattform unterstützt.
Referenzen auf Anfrage erhältlich.
Ihr
Eduard Rappold
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
Sojapulver mit
SPERMIDIN und high-SOJAPROTEIN
Spermidin erhöht die allgemeine Proteinsynthese um das 1,5- bis 2,0-fache.
Raffinose und Stachyrose der Sojabohne haben einen starken präbiotischen Effekt.

40 Portionen
mit
mehr als 1,7mg SPERMIDIN und
mehr als 40 Gramm high-quality Sojaprotein
pro Messlöffel

