Epigenetik und Altern (zelluläre Seneszenz) – Ademetionin und Spermidin als Meilensteine der Zellgesundheit
Epigenetik und Altern (zelluläre Seneszenz)
Ademetionin und Spermidin als Meilensteine der Zellgesundheit
Es zeigte sich, dass die Epigenetik ein Hauptregulator des Zellschicksals und der Zellfunktion ist und eindeutig die Gesundheitsbiologie (Physiologie), die Krankheitsbiologie (Pathologie) und die Langlebigkeit bestimmt.
Verbesserungen in der Gesundheitsversorgung haben in den letzten Jahrzehnten die Lebenserwartung der Menschen erhöht und die ältere Bevölkerung nimmt in den meisten Industrieländern zu. Leider bedeutet dies immer noch eine Zunahme von Jahren mit schlechter Gesundheit oder mit Behinderung.
Da es nicht möglich ist, unseren genetischen Hintergrund, den äußeren Anforderungen folgend, rasch zu ändern, besteht die beste Anti-Aging-Strategie darin, in Verhaltens- und Umweltfaktoren präventiv einzugreifen, um das Auftreten von Risikofaktoren für eine Gefährdung der Gesundheit mit den zur Verfügung stehenden epigenetischen Möglichkeiten zu verringern.
Drei Hauptmerkmale zeichnen die epigenetischen Modifikationen der DNA aus:
1) Sie werden durch Umwelteinflüsse (Exposom) verursacht
2) Sie sind zeitlich begrenzt vererbbar, zumindest über drei Generationen
3) Sie sind lebenslang dynamisch und potentiell reversibel
Die Modifikation der DNA ist heute als einer der Basismechanismen der Epigenetik bekannt. So definiert sich auch die Epigenetik als die „Gesamtheit der übertragbaren und reversiblen Veränderungen der Genexpression, die keine Veränderung der DNA und RNA einschließen“.
Große Meta-Studien zeigen, dass 10 bis 30 Prozent des Risikos für eine chronische Krankheit vom Genom (vererbbar) determiniert ist, während der Rest durch Umwelteinflüsse (zeitlich begrenzt vererbbar) im weitesten Sinne verursacht wird.
Kalorienreduktion schwächt altersbedingte Veränderungen
Bisher wird Kalorienreduktion als eines der wirksamsten und vorteilhaftesten Mittel zur Verzögerung des Fortschreitens des Alterns angesehen, da es die tägliche Kalorienaufnahme verringert und gleichzeitig alle wesentlichen Teile der Makro- und Mikronutrition für den Metabolismus liefern kann.
Die während des Alterns beobachteten abnormalen Zell-Zell-Kommunikationsmuster, einschließlich des übermäßigen proinflammatorischen Ligand-Rezeptor-Zusammenspiels, werden durch Kalorienreduktion umgekehrt. Kalorienreduktion schwächt altersbedingte Veränderungen der Zelltypzusammensetzung, der Genexpression und der regulatorischen Kernnetzwerke der Transkription ab. Die Immunzellen sind während des Alterns erhöht und Kalorienreduktion begünstigt das durch Alterung gestörte Immunökosystem.
Mitochondriale Dysfunktion führt zu einer reduzierten Lebensspanne sowie zu vorzeitig einsetzendem Altern
Die wissenschaftliche Evidenz, dass Altern mit Schädigung und Funktionsstörung der Mitochondrien einhergeht, ist überwältigend. Schon 1992 konnte in mehreren humanen postmitotischen Geweben (u. a. Gehirn und Muskel) gezeigt werden, dass es im Rahmen des Alterns zur Akkumulation von mitochondrialen DNA- (mtDNA)- Mutationen und -Deletionen kommt.
Diese mitochondrialen DNA-(mtDNA)-Schädigung führt zu einer reduzierten Lebensspanne sowie zu vorzeitig einsetzendem Altern unterschiedlicher Organsysteme (zelluläre Seneszenz). Dieser Alterungs-Phänotyp ist verbunden mit einer kontinuierlichen Abnahme der Atmungskettenfunktion und einer verminderten ATP-Produktion durch Mitochondrien mit einer verringerten Energieerzeugungskapazität durch eine verminderte Expression von mitochondrial- kodierten Atmungskettenuntereinheiten. Dies bewirkt eine Störung des Elektronenflusses durch die Atmungskette und hat eine vermehrte ROS-Produktion zur folge.
Bei Überschreiten eines bestimmten Schädigungsschwellenwertes (ca. 60-85% aller mitochondrialen DNA-Moleküle einer Zelle) kommt es zu einer Funktionsstörung und letztendlich zum Untergang der betroffenen Zellen, was sich als „pathologisches Altern“ oder aber als „neurodegenerative Erkrankung“, Herzschwäche oder Leberschaden etc. äußern kann. Organe mit hohem Energiebedarf, wie Gehirn, Leber und Herz- und Skelett-Muskel, sind besonders von diesem Teufelskreis betroffen, da sie einen hohen Sauerstoff-Umsatz haben und geschädigte Zellen nicht in relevantem Umfang erneuert werden können.
Mitochondriale Theorie von Altern und Neurodegeneration als molekularer Teufelskreis
Diese Faktoren können Mutationen in der mitochondrialen DNA, Oxidation von mitochondrialen Proteinen, Destabilisierung von Atmungskettenkomplexen, Veränderungen in der Zusammensetzung der Mitochondrienmembran, Veränderungen in der Mitochondriendynamik und unzureichende Qualitätskontrolle durch Mitophagie sein. – Mitophagie ist der Prozess des Erkennens und Entfernens abnormaler Mitochondrien durch den Autophagie-regulierten-Abbau.
Die mitochondriale Theorie von Altern und Neurodegeneration (Harman 1972) postuliert einen molekularen Teufelskreis, in dem sich oxidativer Stress und Schäden an mitochondrialen Proteinen und mitochondrialer DNA (mtDNA) gegenseitig verstärken.
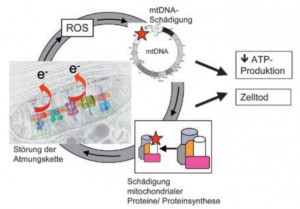
Abb. mitochondriale Theorie von Altern und Neurodegeneration
Klinik der erworbenen mitochondrialen Dysfunktion
Mitochondriale Erkrankungen können einerseits als Erbkrankheiten definiert werden, die aus Mutationen in mitochondrialer DNA oder nuklearer DNA resultieren, die die Mitochondrienfunktion beeinträchtigen.
Andererseits können altersbedingte Erkrankungen, bei denen eine beschädigte Mitochondrienfunktion vorliegt, als erworbene mitochondriale Dysfunktion angesehen werden.
Die phänotypischen Anzeichen einer verminderten Mitochondrienfunktion sind beeinträchtigte Fitness, Stoffwechselentgleisungen, kognitive Funktion- und Gedächtnis- Beeinträchtigung, die die zugrunde liegende Organfunktionsstörung ankündigen.
Alle epigenetisch wirksamen externen Faktoren werden zusammenfassend als Exposom bezeichnet
Der Begriff Exposom setzt sich aus expose (aussetzen) und Genom (Gesamtheit unserer Gene) zusammen. Es geht dabei also um alle äußeren Faktoren, die ein bestimmtes Maß an Einfluss auf genetisches Material, um ein Protein zu exprimieren oder stummzuschalten, ausüben können.
Einer der rudimentärsten Einflüsse auf das Epigenom ist die Zusammensetzung der Nahrung, einfach weil Nahrung für das Überleben aller biologischen Entitäten wesentlich ist. Es wird geschätzt, dass >60% der Todesfälle eher darauf zurückzuführen sind, wie und was wir essen, als auf Umweltauslöser oder in einigen Fällen sogar auf genetische Veranlagungen.
Spezifische Nährstoffe, die für metabolische Methylierungswege benötigt werden, können das Epigenom aufgrund ihrer funktionellen Rolle bei der Steuerung von DNA-Methylierung / Histon-Modifikationen stärker als andere direkt beeinflussen.
Dazu gehören Aminosäuren aus der Nahrung wie Lysin (erforderlich für Modifikationen der Histon-Arme); Methionin als Vorläufer des S-Adenosyl-L-Methionin (Ademetionin) als Methylgruppendonator, Vitamine B6, Vitamin B12 und Vitamin B2; Folsäure; Biotin-Cholin / Betain und spezifische Mineralien (Mg, Zn) die gemeinsam den 1-Kohlenstoff-Metabolismus und die Nukleotidbiosynthese vorantreiben.
Spermidin fördert die Autophagie und hemmt die Apoptose
Adäquate Spermidin-Zufuhr zur Deckung des Tagesbedarfs von mindestens 80 µmol (Mikromol) Spermidin pro Tag bestimmt als unabhängige Einflussgröße die Lebensdauer.
Der Gesamtkörperpool an Spermidin sowie die enzymatische Aktivität von Ornithin Decarboxylase (ODC) nimmt in der Regel mit zunehmendem Alter tendenziell ab.
Die De-novo- Synthese von Spermidin im Organismus braucht die Hilfe von S-Adenosyl-L-Methionin (Ademetionin) und die S-Adenosyl-L-Methionin-Biosynthese verringert sich bereits im frühen Erwachsenenalter (ca. ab dem 35. Lebensjahr).
Niedere Spermidin-Werte im Blut finden sich nicht nur im Alter, sondern auch bei Personen deren Stoffwechsel verlangsamt ist .
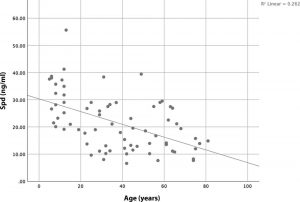
Abb. Bivariate Korrelation zwischen Serum-Spermidinspiegeln und Alter. Der Pearson-Korrelationskoeffizient zwischen Spermidinspiegel und Alter beträgt –0,512 ( p <0,001).
Referenz:
Pekar T, Wendzel A, Flak W, Kremer A, Pauschenwein-Frantsich S, Gschaider A, Wantke F, Jarisch R. Spermidine in dementia : Relation to age and memory performance. Wien Klin Wochenschr. 2020 Jan;132(1-2):42-46.
Auf dem Weg der Amino-Propylation wird Putrescin durch Spermidinsynthase durch Addition einer Propylamingruppe, die aus der Decarboxylierung von S-Adenosylmethionin stammt, in Spermidin umgewandelt.
Spermidin, ein Polyamine, bewirkt an der Mitochondrienmembran eine Stabilisierung und Neutralisierung der Mitochondrienoberfläche durch Verbindung der Polyamine mit den Phospholipiden. Die Membran wird impermeabel und widerstandsfähiger gegen erhöhte mechanische Beanspruchung .
Die Stabilisierung von Nukleinsäuren basiert auf einer Komplexbildung zwischen den basischen Aminogruppen der Polyamine und den sauren Phosphatgruppen der Nukleinsäuren. Die damit einhergehende Neutralisierung der Phosphate bewirkt einen Nettoanstieg der Anziehungskräfte (van der Waals, Wasserstoffbrückenbindungen) und so eine Verstärkung der Sekundärstrukturen wie z.B. DNA-Doppelhelix.
Histondeacetylase (HDAC)-Inhibitoren verhindern einen Teil der altersbedingten Verschlechterung durch Verlängerung der Mitochondrien-Lebensdauer
Neben den stabilisierenden Effekten gibt es starke Hinweise darauf, dass Histondeacetylase- (HDAC)-Inhibitoren einen Teil der altersbedingten Verschlechterung verhindern oder rückgängig machen können. In mehreren Studien wurde gezeigt, dass Butyrat (Butterschmalz) ein HDAC-Hemmstoff die Biogenese der Mitochondrien erhöht und zu einem Anstieg des Sauerstoffverbrauchs führt. Zusätzlich führen verschiedene HDAC-Inhibitoren zu einer Verlängerung der Mitochondrien-Lebensdauer.
Der Einfluss der Histondeacetylase (HDAC)-Hemmung auf die Altersmerkmale, wie: Epigenetische Veränderungen, Telemer-Abrieb, Genomische Instabilität, Verlust der Proteostase, Deregulierte Nährstoffsignalisierung, Mitochondriale Dysfunktion, Zelluläre Seneszenz, Stammzellen Erschöpfung und veränderte interzelluläre Kommunikation, steht im Allgemeinen im Einklang mit positiven Veränderungen für die Gesundheit des Menschen.
Häufige “Alterskrankheiten”
Die sogenannten „altersbedingte“ Krankheiten werden erst nach Jahrzehnten manifest und gelten dann als Alterskrankheiten. Ihr Start liegt im mittleren Lebensalter, nämlich dann, wenn bei mangelhafter S-Adenosyl-L-Methionin (Ademetionin)- und Spermidin- Biosynthese es zur Hypomethylierung und konsekutiver Expression der „Altersproteine“, die der Anlass der „altersbedingten Krankheiten“ sind, die allesamt eine mitochondriale Dysfunktion und eine Beeinträchtichung der Autophagie zeigen, kommt.
Die häufigen Alterskrankheiten, darunter Typ-2-Diabetes, Fettleibigkeit, Alzheimer-Krankheit und Parkinson-Krankheit, werden nicht durch einzelne genetische Defekte verursacht. Die Alterskrankheiten resultieren vielmehr aus einer Kombination von Faktoren, einschließlich des quantitativen Beitrags mehrerer Gene, sogenannte quantitative Trait Loci (QTL). – QTLs stellen die Region eines quantitativen Merkmals auf einem Abschnitt eines Chromosoms für die Ausprägung eines quantitativen phänotypischen Merkmals dar.
Epigenetisch wirksame externe Faktoren (Exposom) sind im wesentlichen Armut, mangelnde Bildung, gesundheitliche Ungleichheiten, als auch Lifestylefaktoren wie mangelnde Bewegung, toxischer Stress, inadäquate Ernährung, Rauchen, Drogen und Alkohol.dass die Exposition Auch gegenüber Luftverschmutzung werden die epigenetischen Modifikationszustände verändert.
Das Alter per se mit um 3 – 4 fach erhöhten Monoamino-Oxidasen-Werten und mit einer Deregulierung verschiedener Signalwege, wie z. B. des Insulin-IGF1-Weges (Insulin-like Growth Factor 1), des Rapamycin (mTOR) -Pfades, des AMP-aktivierte Proteinkinase (AMPK) -Pfades und der Sirtuin-Pfade, induziert eine mitochondriale Dysfunktion und verschiebt das Epigenom des Erwachsenen in Richtung Morbidität.
Epigenetische Signaturen ändern sich mit zunehmendem Alter auf natürliche Weise
Epigenetische Signaturen ändern sich mit zunehmendem Alter auf natürliche Weise. Im Allgemeinen ist eine Abnahme der DNA-Methylierung im Genom (Hypomethylierung) zu verzeichnen, mit einer paradoxen Hypermethylierung bestimmter Genpromotoren im gesamten Genom.
Interessanterweise treten bei der Krebsentstehung dieselben DNA-Methylierungsmuster auf, die beim Altern beobachtet werden, wobei Tumorsuppressorgene durch Hypermethylierung ihres Promotors unterdrückt werden..
Veränderungen der Histonmodifikationen scheinen auch mit dem Alter aufzutreten. Es wurde gezeigt, dass in-vitro-Seneszenz mit einer Abnahme der repressiven Histonmark-Histon-3-Lysin-27-Trimethylierung sowie einer Zunahme der Methylierung von Histon-4-Lysin-20 einhergeht, was auf eine heterochromatische Region hinweist, wodurch die Gentranskription unterdrückt wird. Diese Veränderungen der epigenetischen Muster können zu altersbedingten Krankheiten, Krebs oder einem verfrühten Alterungsprozess selbst beitragen.
Es wurde gezeigt, dass die Monoubiquitinierung von Histon H2B eine Rolle bei der Regulation der Autophagie spielt. – Als Ubiquitinierung bezeichnet man die Übertragung von Ubiquitin auf ein Zielmolekül.
Autophagie ist ein permanentes Notfallsprogramm zur Zellerleichterung
Zelluläre Seneszenz (Altern) ist mit einer verminderten Autophagie verbunden.
Die Autophagie ist ein grundlegender Prozess, um die Herz- und Gefäßgesundheit während des Alterns sicherzustellen.
Bei dem fortlaufend stattfindenden Autophagie-Prozess werden etwa geschädigte oder funktionslose Proteine oder Zellorganellen verdaut und aus dem Verkehr gezogen. Man kann sich das wie eine Art Müllabfuhr vorstellen, allerdings mit Recyclinganlage (Proteasom), denn einzelne noch verwertbare Bestandteile werden wiederverwendet.
Gäbe es keine Autophagie, würden die Müllsäcke unserer Zellen überquellen. Außerdem werden bei dem Prozess nicht nur Proteine oder Zellorganellen heraussortiert und abgebaut. Es können auf diese Weise auch pathogene Eindringlinge wie Viren, Bakterien oder andere Mikroorganismen in der Zelle bekämpft werden. Damit kommt der Autophagie bei Infektionen beim Alterungsprozess, bei der Entstehung von Tumoren und Krankheiten eine Schlüsselfunktion zu.
Autophagie im Alter und Immunseneszenz (Inflamm-aging)
Als Hüter unseres Körpers erhält das Immunsystem die systemische Gesundheit, indem es auf Krankheitserreger reagiert und eine kontinuierliche Überwachung gegenüber Gewebeschäden und die Entwicklung von Tumorzellen bietet.
Die Immunseneszenz ist ein wichtiger Risikofaktor für viele altersbedingte Krankheiten, auch Krebs und erhöhte Infektionsanfälligkeit bei älteren Menschen und hat daher in den letzten Jahren viel Aufmerksamkeit erregt.
Inflamm-aging beschreibt die altersabhängige Zunahme eines entzündlichen Milieus und steht im Zusammenhang mit kardiovaskulären Pathologien, Diabetes mellitus und Rheumatoider Arthritis.
Ursachen von Inflamm-aging sind die Zunahme pro-inflammatorischer Parameter und es sind die Zellen des Immunsystems sind betroffen.
Es kommt zur Abnahme an naiven T-Lymphozyten im Alter durch Thymusinvolution und Funktionsverlust pluripotenter Stammzelle, zu einer Abnahme naiver T-Zellen bei gleichzeitiger Zunahme von Effektor-/Memory T-Zellen, zu eine Zunahme von terminal differenzierten T-Zellen und zu einer Kompensation durch Proliferation von Memory T-Zelle, zu verminderter Telomerenlänge und verstärkter Produktion pro-inflammatorischer Zytokine.
Die Autophagie ist während des Alterns in verschiedenen Geweben, einschließlich der Immunzellen, beeinträchtigt.
Autophagie-defiziente Immunzellen weisen mehrere alternde Phänotypen auf, da miit zunehmendem Alter sich einige wichtige Autophagie-regulierende Pfade, ändern, die sich als wichtig für die Verjüngung oder eine verzögerte Alterung sind.
Zudem ist die Autophagie ein wichtiger Qualitätskontrollmechanismus zur Aufrechterhaltung der zytoplasmatischen Gesundheit und der zellulären Homöostase.
Eine Autophagie-Induktion durch Spermidin verbessert die Immunantwort gegen mikrobielle Infektionen bei älteren Menschen.
Es wurde beobachtet, dass Virusinfektionen das Altern des Menschen beschleunigen, was sich auf die CpG-Methylierung der Erbsubstanz auswirkt und damit auf der epigenetische Uhr bezüglich einer Änderung des biologischen Alters sichtbar wird. – Eine epigenetische Uhr ist eine Methode, um anhand des Grads der DNA-Methylierung das biologische Alter eines Menschen zu bestimmen.
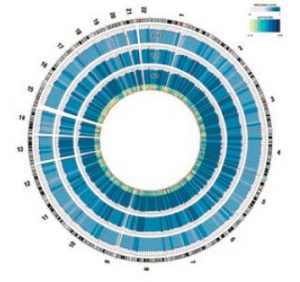
Abb. Kreise mit altersabhängigem Methylierungsmuster
Referenz:
Horvath, S. DNA-Methylierungsalter von menschlichen Geweben und Zelltypen. Genome Biol 14, 3156 (2013).
Ademetionin- und Spermidin- Biosynthese sind vom Lebensalter abhängig
Die Entwicklung eines Ademetionin- (S-Adenosyl-L-Methionin) – Mangels ist vom Lebensalter abhängig. Um das 35. Lebensjahr ist bereits die Ademetionin- (S-Adenosyl-L-Methionin)-Biosynthese um ein Drittel verringert und der Ademetionin- (S-Adenosyl-L-Methionin) – Mangel gibt nicht mehr die Möglichkeit, die Überexpression der Monoamin-Oxidasen (MAOB und MAOA) an den Mitochondrien-Membranen zu verhindern. So begünstigt die von den MAOB und MAOA induzierte zytotoxisch wirkende oxidative Stressbelastung aus der oxidativen Desaminierung der monoaminergen Gehirnbotenstoffe allmählich die Entstehung verschiedener degenerativer Erkrankungen.
Die Spermidin-Biosynthese erfolgt bei Anwesenheit von Ademetionin (S-Adenosyl-L-Methionin) mittels Aminopropylation im C1-Zyklus und ist ebenso bereits um das 35. Lebensjahr um ein Drittel verringert.
Ademetionin und Spermidin als Meilensteine der Zellgesundheit
So ist die adäquate Bereitstellung von Ademetionin (S-Adenosyl-L-Methionin) als singulärer Methylgruppen-Donator zum Schutz der Mitochondrien und Spermidin, das vor den negativen Konsequenzen des Alterns schützt und die Lebensdauer verlängert, für die Zellgesundheit unumgänglich.
Spermidin induziert die Autophagie: Spermidin als „natural autophagy inducer“ hilftmit die Gesundheit durch Zellverjüngung zu erhalten und die Stabilität der Zelle vor toxischer Überladung durch zellulären Abfall zu unterstützen (Frank Madeo). Dieser zelluläre Prozess ist die Autophagie, die Abbauprozesse ermöglicht und so die Lebensdauer verlängern kann (Yoshinori Ohsumi erhielt 2016 den Medizin-Nobelpreis für die Beschreibung des Autophagieprozesses).
Autophagie wird so für die Aufrechterhaltung der Proteinhomöostase wichtig, also eines Gleichgewichts zwischen Synthese, Faltung und kontrolliertem Abbau von Proteinen. Spermidin kann neusynthetisierten Proteinen „helfen“ sich korrekt zu falten und verhindert so eine mögliche toxische Überladung durch zelluläre Abfallprodukte.
Spermidin ist ein wichtiger Wachstumsfaktor
Spermidin ist ein wichtiger Wachstumsfaktor, der eine Rolle bei der Stabilität von Messenger-RNAs (mRNAs) und so auch Einfluss auf die Translation (Proteinsynthese), RNA-Bindung, RNA-Synthese, RNA-Synthese-Komplex und Regulation des Membranpotentials hat.
Spermidin verlängert die Lebensdauer
Spermidin ist ein Kalorienrestriktions-Mimetikum und wirkt so als einer der Alterungsprotektoren, welche die Signalkaskaden des Fastens einleiten, obwohl man nicht fastet. Hunger induziert wiederum die Spermidin-Synthese.
Gesund bis auf die Zelle
Bei der Autophagie werden schadhafte Proteine oder Organellen in einer Doppelmembran, dem Autophagosom, eingekapselt und später abgebaut.
.
© Verena Bauman
Unsere Zellen und dazu zählen auch die Zellorganellen, wie die Mitochondrien und Autophagosomen, sind kleine Lebewesen. Wenn sie gesund erhalten werden, heißt das auch für den Organismus als Ganzes ein Altern in Gesundheit bei Zellgesundheit und Langlebigkeit.
Ihr
Eduard Rappold
Meilensteine der Zellgesundheit
– Ademetionin und Spermidin –
vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
EBP® – Epigenetic Brain Protector
zum Schutz vor Gehirnzellenuntergang
enthält 400 mg Ademetionin (S-Adenosyl-L-Methionin) pro Kapsel seiner biologisch aktiven (S,S) Form in präventiver Dosierung

NUGENIS Goldmedaille Iena 2015
für hervorragende Leistungen
zum Schutz vor Gehirnzellenuntergang
https://nugenis.eu/shop/

Sojapulver mit
SPERMIDIN und high-quality-SOJAPROTEIN
induziert die Autophagie und verringert das
Risiko für Herz/Kreislauf-Erkrankungen
40 Portionen
mit
mehr als 1,7mg SPERMIDIN pro Messlöffel
www.spermidine-soyup.com
