S-Adenosyl-L-Methionin (Ademetionin) und Epigenetik – 2.Teil: Die mitochondriale Dysfunktion bei S-Adenosyl-L-Methionin (Ademetionin) – Mangel
Die mitochondriale Dysfunktion
Wir alle haben den gleichen Ursprung und sind mit sämtlichen Lebewesen dieser Erde aufgrund unserer Gene verwandt. Wir sind in gegenseitiger Abhängigkeit mit allen Lebewesen sowie den geologischen und atmosphärischen Gegebenheiten.
Etwa vier Milliarden Jahre brauchte es, bis auf der Erde Tiere, Menschen und Pflanzen entstehen konnten.
Zwei große biologische Revolutionen waren dazu notwendig:
Vor mehr als 2,5 Milliarden Jahren vollzieht das Leben auf der Erde einen entscheidenden Schritt: Bisher bezogen die Einzeller ihre Lebensenergie aus einer Vielzahl chemischer, lichtunabhängiger Prozesse, wie auch heute noch. Nun entwickeln sie zusätzlich die Photosynthese, durch die sie, wie später die Pflanzen, mithilfe der Lichtenergie aus Kohlendioxid und Wasser Zucker bilden. So wird das in Chloroplasten durch Photosynthese erzeugtes ATP die primäre Quelle für biologisch nützliche Energie auf unserer Erde.
Der zweite alles entscheidende Schritt war der Transfer dieser Erfindung durch Endobiose. Die Natur hatte das Mitochondrium erfunden.
So entstanden vor Milliarden Jahren unsere Lebensenergiebereitsteller, die Mitochondrien, durch Endobiose aus einem Alpha-Proteobakterium, das einen eukaryotischen Vorläufer inkorporierte. Es war dies die Schlüsselinnovation auf dem Weg zum multizellulären Leben. Es gab nun genügend Energie, um sich den Luxus von Organen mit hohem Energieverbrauch leisten zu können. Die physiologische Funktion unserer Organe Gehirn, Herz, Muskel und Leber wäre ohne mitochondrialer Energiebereitstellung undenkbar.
Ohne Mitochondrien wären wir in großen Schwierigkeiten, denn schon eine erworbene mitochondriale Dysfunktion ist der Grund vieler schwerer Krankheiten und es gäbe eine globale biologische Energiekrise, wenn es keine Chloroplasten der Pflanzen gäbe. Glücklicherweise hat die genomische Evolution in den letzten zwei Milliarden Jahren dafür gesorgt, dass die Funktionen dieser Schlüsselorganellen bei uns geblieben sind.
Chloroplasten-ATP-Synthasen und Mitochondrium-ATP-Synthasen sind zentrale Bestandteile aller membranbasierten biologischen Energieumwandlungssysteme und die einzigen bekannten makromolekularen Maschinen, die einen elektrochemischen Transmembrangradienten direkt in die chemische Energie einer kovalenten Bindung umwandeln. ATP-Synthasen von Chloroplasten, Mitochondrien und Bakterien stimmen im Wesentlichen mit demselben Bauplan überein.
Diese bereits vor Milliardenjahren fixierte Antiquiertheit unseres Stoffwechsels startete mit der Erfindung des Chloroplasten/Mitochondriums die ATP Produktion. ATP ist Bauteil des S-Adenosylmethionins (Ademetionin), dem einzigen Methylgruppen- Lieferanten für die Erbsubstanz (Genom). Genorte können so stillgelegt oder aktiviert werden und Ademetionin machte erst die Spermidin-de novo Biosynthese für Autophagie möglich.
Mitochondriale Dysfunktion ist ein sehr frühes Ereignis
Neurodegenerative Erkrankungen stellen eine wachsende Belastung für die globalen Gesundheitsressourcen dar. Die Weltgesundheitsorganisation (WHO) schätzt, dass neurologische Störungen bis 2030 etwa 12 Prozent der jährlichen Todesfälle ausmachen werden.
Angesichts des wachsenden Ausmaßes neurologischer Erkrankungen, insbesondere in Ländern mit zunehmender Alterung der Bevölkerung, versuchen Forscher seit Jahrzehnten, die Ursachen der Neurodegeneration zu ermitteln und kausaltherapeutisch weitgehendst erfolglos vorteilhafte Wirkstofftargets zu identifizieren.
Mitochondrien spielen in einzigartiger Weise eine entscheidende Rolle für das Überleben oder den Tod neuronaler Zellen, da sie sowohl den Energiestoffwechsel als auch den Zelltod regulieren. In der Tat gibt es starke Anzeichen dafür, dass oxidativer Stress vor dem Auftreten der Symptome bei Alzheimer-Krankheit auftritt und dass oxidative Schäden nicht nur in den anfälligen Regionen des Gehirns, die von der Krankheit betroffen sind, sondern auch im Riechhirn und peripheren Leukozyten auftreten. Eine olfaktorische Dysfunktion (schwerer Anosmie) bei Alzheimer-Krankheit und einer leichten kognitiven Beeinträchtigung, die das Fortschreiten der Demenz ankündigt, hängt mit der Ablagerung von pathologischen Proteinen, wie α-Synuclein, hyperphosphoryliertem Tau-Protein und Neurofilament-Protein in diesen Bereichen zusammen.
Referenzen:
- Nunomura et al. Oxidativer Schaden ist das früheste Ereignis bei der Alzheimer-Krankheit. J. Neuropathol. Exp. Neurol., 60 ( 2001 ) , S.. 759 – 767
- Honda et al. Ribosomale RNA bei Alzheimer-Krankheit wird durch gebundenes redoxaktives Eisen oxidiert. J. Biol. Chem. , 280 ( 2005 ) , S.. 20978 – 20986
- Perry et al. Oxidative Schädigung im olfaktorischen System bei Alzheimer-Krankheit. Acta Neuropathol. , 106 ( 2003 ) , S.. 552 – 556
- Johannes Attems, Lauren Walker, Kurt Jellinger. Olfactory bulb involvement in neurodegenerative diseases. Acta Neuropathologica 127 (4). 2014
Mitochondriale Dysfunktion ist ein sehr frühes Ereignis beim Altern und bei vielen neurodegenerativen Erkrankungen, wie Huntington (HD = Huntington’s disease), Parkinson (PD = Parkinson’s disease), Alzheimer Demenz (AD = Alzheimer’s disease), Amyotrophe Lateralsklerose (ALS = amyotrophic lateral sclerosis), Schlaganfall, und Epilepsie (Lin et al., 2006).
Zudem liefern Untersuchungen in den letzten Jahren auch Hinweise für eine Fehlfunktion der Mitochondrien bei psychiatrischen Erkrankungen, wie z.B. Bipolarer Störung und Depression (Kato, 2006; Shelton, 2007).
Es findet sich auch potenzielle Überschneidung zwischen psychiatrischen Störungen und Stoffwechselstörungen, wie dem Diabetes mellitus.
ATP und S-Adenosylmethionin (Ademetionin) sind Schlüsselmoleküle im intermediären Stoffwechsel
Die Genexpression ändert sich ständig, wird aber lifestyle-& altersabhängig durch die Abnahme der S-Adenosylmethionin-Produktion in der Leberzelle und von Quantität und Qualität der Mitochondrien und der ATP-Produktion beeinflusst.
S-Adenosylmethionin ist der wesentliche Methylgruppendonor für die nDNA und mtDNA. Bei S-Adenosylmethionin-Mangel kommt es zum Aktivitätsanstieg der MAOB, im Alter per se um das 3 – 4-Fache, bei LOAD und bei der Depression im Alter.
Die ROS Produkte aus der oxidativen Desaminierung von Monaminen, wie Dopamin, sind neuro- und gliatoxisch.
MAO B, die an der äußeren Mitochondrienmembran und MAO A, die an der inneren Mitochondrienmembran lokalisiert sind, sind die Ort der oxidativen Desaminierung. Die toxischen Endprodukte führen direkt zum Mitochondrienschaden (mitochondriale Dysfunktion, Apoptose).
Die ATP-Produktion hängt von der Integrität der Mitochondrien (OXPHOS ist an der inneren Mitochondrienmembran lokalisiert) ab und die Alteration des Mitochondriums schränkt die ATP-Produktion und den Stoffwechsel für den Organismus ein.
Neurodegeneration, Gliose, Blut/Gehirn-Barriere-Dysfunktion und dem zur Folge Neuroinflammation und Neuro- und Gliatoxizität sind die Endpunkte dieser Entwicklung.
Referenz:
Picard M. et al. Mitochondrial functions modulate neuroendocrine, metabolic, inflammatory, and transcriptional responses to acute psychological stress. Proc Natl Acad Sci U S A. 2015 Dec 1;112(48): E6614-23.
Mitochondriale Dysfunktion ist ein frühes Ereignis bei der Alzheimer-Krankheit
Swerdlow und Khan haben vorgeschlagen, die Mitochondrien – Kaskade Hypothese für die LOAD (late onset AD) für ursächlich zu erklären.
Kurz gesagt, diese Hypothese besagt, dass bei der sporadischen Alzheimer Krankheit die mitochondriale Dysfunktion das Hauptereignis ist, das die Ablagerung von Aβ (Amyloidopathie), die synaptische Degeneration und die Bildung von Neurofibrillary tangles (NFTs) als Tauopathie verursacht.
Referenzen:
RH Swerdlow , SM Khan. Eine „mitochondriale Kaskadenhypothese“ für die sporadische Alzheimer-Krankheit. Med. Hypotheses , 63 ( 2004 ) , S. 8 – 20
RH Swerdlow , SM Khan. Die mitochondriale Kaskadenhypothese der Alzheimer-Krankheit: Ein Update. Exp. Neurol. , 218 ( 2009 ) , S.. 308 – 315
Mitochondriale Dysfunktion, oxidativer Stress und Autophagie hängen eng mit der Alzheimer-Krankheit-Pathogenese zusammen
Darüber hinaus konnte gezeigt werden, dass oxidative Schäden vor der Bildung von Aβ-Plaques auftreten. Tauopathie geht der Amyloidopathie bei Alzheimer-Krankheit um nahezu 30 Lebensjahre voran.
Mitochondrien sind an der Apoptose beteiligt, der am besten charakterisierten Art des programmierten Zelltods (PCD). PCD beinhaltet ein komplexes Netzwerk von biochemischen Pfaden und ist bei physiologisch normalen Prozessen vorhanden.
Die die PCD auslösenden Ursachen, sind variabel und umfassen eine moderate Überaktivierung von Glutamatrezeptoren, mitochondriale Dysfunktion, Ca2 + -Überladung, oxidativen Stress und DNA-Schäden.
Referenz: MO Hengartner Die Biochemie der Apoptose. Nature, 407 ( 2000 ) , S. 770 – 776
Die Makroautophagie wird sowohl im AD-Gehirn induziert und beeinträchtigt, was zur Akkumulation von Aβ-haltigen autophagische Vakuolen (AVs) in betroffenen Neuronen führt ( Nixon et al., 2005 ; Yu et al., 2005 ).
Andererseits reguliert die Mitochondrien Funktion die Langlebigkeit durch die Modulation des Epigenoms und verbindet damit zwei wichtige Merkmale des Alterns – mitochondriale Dysfunktion und epigenetische Veränderungen – bei der Bestimmung der Lebensdauer.
Zitat: „Der Mechanismus, der der Veränderung der Enzymaktivitäten zugrunde liegt, ist unklar. Es scheint eine Verbindung zwischen einer erhöhten Monoaminoxidase-B und Monoaminooxidase A-Aktivität und degenerativen Prozessen im Gehirn zu bestehen, die zum Verlust der neuronalen Aktivität führen“.
Referenz:
Fowler CJ, Carlsson A, Winblad B. Monoamine oxidase-A and -B activities in the brain stem of schizophrenics and non-schizophrenic psychotics. J Neural Transm. 1981;52(1-2):23-32.
Geht es den Mitochondrien gut, dann sind wir gesund!
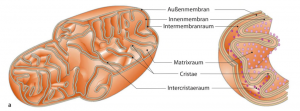
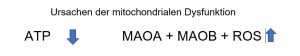
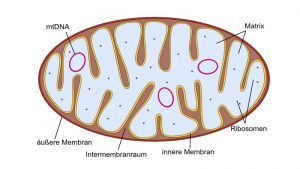
Der mitochondriale Stoffwechsel steuert die Spiegel der wichtigsten Signalmoleküle wie ATP, Acetyl-CoA, NADH, NAD + und deren Verhältnis zu S-Adenosylmethionin (Ademetionin).
Cytosolisch synthetisiertes S-Adenosylmethionin (Ademetionin) wird mithilfe des spezifischen Mitochondrienträgers S-Adenosylmethionin (Ademetionin) -Träger (SAMC) in die Mitochondrien transportiert, um die Methylgruppe für alle mitochondrialen Methylierungsprozesse bereitzustellen.
Die Methylierung von nDNA und mtDNA stellt einen Mechanismus zur gegenseitigen Kontrolle der Mitochondrien- und Zellfunktion dar. Von der nuklearen Seite aus werden viele kernkodierte Mitochondrienproteine epigenetisch reguliert, was die Mitochondrienfunktion beeinflusst. MicroRNAs (miRNAs) können ebenso die Mitochondrienfunktion regulieren.
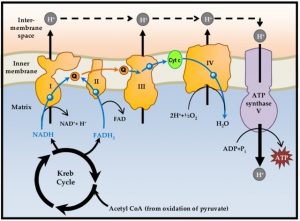
Die Energiebilanz der Zellatmung liegt bei maximaler Ausnutzung der Energie bei 38 ATP pro Glucosemolekül – jeweils 2 ATP aus der Glykolyse und dem aus Citratzyklus und 34 ATP aus der Atmungskette.
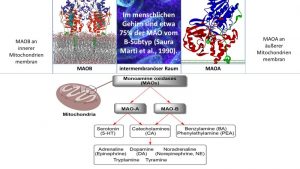
Der Anstieg der Monoaminoxidase- Expression hat dekonstruktive Kompetenz durch reaktive Sauerstoff- und reaktive Stickstoff -Spezies
Eine erhöhte MAO B- und MAO A- Aktivität belastet das Mitochondrium selbst und die Zellen mit toxischen Endprodukten aus der oxidativen Desaminierung beim Abbau von Neurotransmitter wie Dopamin, Serotonin, Noradrenalin und Phenylethylamin.
Eine erhöhte MAOB-Expression findet sich:
- im Alter, hier ist die MAOB auf das 3 bis 4-fache erhöht, bei der
- Alzheimerkrankheit mit spätem Beginn (80% der Demenzen), bei
- toxischem Stress, Burnout und Depressionen,
- bei Rauchern, 24 Prozent der Österreicher rauchen täglich (Stand: 2015),
- Alkoholabusus, etwa 340.000 Menschen gelten als alkoholkrank, knapp 735.000 Österreicher konsumieren Alkohol regelmäßig in einem gesundheitsschädlichen Ausmaß.
- PPI-Langzeiteinnahme und einer
- langdauernden systemischen Cortison-Therapie
Reaktive Sauerstoff- und reaktive Stickstoff -Spezies
Meist handelt es sich dabei um freie Radikale, also Atome oder Moleküle, die ein oder mehrere ungepaarte Elektronen besitzen und deswegen danach streben, mit anderen chemischen Verbindungen zu reagieren und Elektronen aufzunehmen, wodurch sie reduziert und letztere oxidiert werden.
Es gibt auch stabile Elektronenkonfigurationen die ebenfalls oxidierende Eigenschaften haben und genauso zu den reaktiven Verbindungen gezählt werden.
All diesen ROS und RNS ist gemeinsam, dass sie durch Oxidationsprozesse an zellulären Makromolekülen wie DNA, RNA, Lipiden, Proteinen oder Nukleinsäuren Zellschäden hervorrufen können und dadurch die Integrität und Funktionalität der Zelle gefährden.
85% aller ROS fallen auf diese Weise als Nebenprodukt der Zellatmung und aus der oxidativen Desaminierung der Monamine von MAO A in der Mitochondrien-Matrix an (Boveris und Chance 1973; Milton und Sweeney 2012). Aber auch im intermembranösen Raum der Mitochondrien durch die toxischen Endprodukte aus dem Abbau der Monamine durch MAO B und extramitochondrial werden reaktive Sauerstoffspezies generiert. Beispielsweise phagozytieren Zellen des Immunsystems, wie neutrophile Granulozyten und Makrophagen, Bakterien und Viren und bilden durch das Enzym NADPH-Oxidase Superoxid-Anionen, um die aufgenommenen Keime zu zersetzen und unschädlich zu machen (Bedard und Krause 2007).
Neben reaktiven Sauerstoffspezies gibt es auch die bereits erwähnten reaktiven Verbindungen des Stickstoffs (RNS). Die in zahlreichen Geweben vorkommende Stickstoffmonoxid-Synthase katalysiert die Reaktion der Aminosäure L-Arginin zu L-Citrullin und Stickstoffmonoxid (•NO).
•NO gilt als wichtiges Signalprotein in diversen physiologischen Prozessen, wie beispielsweise der Neurotransmission, der Hämodynamik, beim Schlaf oder der Immunabwehr. Im Rahmen entzündlicher Prozesse entsteht in Abwehrzellen aus •NO und O2 • – das radikale Peroxinitrit-Anion (ONOO- ), welches als potentes Oxidationsmittel ebenfalls der Abwehr von Pathogenen dient, während es auf zellulärer Ebene, ähnlich wie das Hydroxyl-Radikal, zu Schäden von Makromolekülen führen kann (Halliwell 2006).
Diese toxischen Abbauprodukte sind als Oxidativer Zell- Stress, als reaktive Stickstoffspezies, Peroxynitrit ONOO− und als reaktive Sauerstoffspezies:
- Hyperoxid Anion (O2–)
- Hydroxyl-Radikal (HO·)
- Peroxylradikal (ROO·)
- Alkoxylradikal (RO·)
- Wasserstoffperoxid (H2O2)
- Hydroperoxid (ROOH)
- Ozon (O3)
- Hypochlorit-Anion (OCl−)
- Singulett-Sauerstoff (1O2)
bekannt, die ein Nebenprodukt der Zellatmung sind, aber hauptsächlich durch Monoaminooxidasen, wie MAO B und MAO A, beim Abbau von monaminergen Botenstoffen (Neurotransmitter), wie Dopamin und Serotonin entstehen.
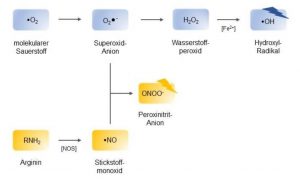
Abb. Entstehungsweg der häufigsten ROS und RNS
Ein gesundes Gehirn hat keinen hohen Gehalt an reaktiven Sauerstoffspezies, aber im Fall von Alzheimer Krankheit und Multipler Sklerose wird angenommen, dass ein oxidativer Ausbruch – eine plötzliche Freisetzung von ROS, Neuronen und Myelin produzierende Zellen, sogenannte Oligodendrozyten und Astrozyten zerstören.
Über diese Maschinerie zur Produktion von ROS verfügen Makrophagen als periphere Immunzellen, die bei defekter neurovaskulärer Einheit (NVU) in das Gehirn gelangen können.
Es zeigte sich, dass über 80 Prozent der Zellen im Gehirn, die Gene für die Sekretion von ROS exprimieren Makrophagen sind. Auch eine bestimmte Population von Mikroglia, genannt MGV, können als aktivierte Mikroglia eine Vielzahl entzündungsfördernder Zytokine wie Interleukin (IL) -1β, IL-6, Tumornekrosefaktor (TNF) -α freisetzen, verfügt über die Maschinerie zur Herstellung von ROS und haben damit die „Gensignatur für oxidativen Stress“.
Innerhalb dieser Gensignatur werden drei Hauptkategorien von Genen coexprimiert: Gene für oxidativen Stress, Gene für den Glutathionweg (der Reduktions- und Oxidationsreaktionen reguliert) und Gene, die die Blutgerinnung fördern, wobei das Protein Fibrin, ein wesentlicher Faktor für die Blutgerinnung, als Aktivator von Mikrogliazellen ist.
Diese Gensignatur wurde auch als Biomarker bei Alzheimer getestet, was darauf hindeutet, dass es eine gewisse Überschneidung zwischen der Expression von Genen gibt, die mit oxidativem Stress bei Morbus Alzheimer zusammenhängen.
Die Gehirne von Patienten mit Multipler Sklerose und Alzheimer weisen Gefäßanomalien oder Schäden durch Fibrinablagerungen auf und zeigen, dass eine Gefäßverletzung oxidativen Stress auslöst. Eine weitere Schädigung des Gefäßsystems aufgrund dieses Zustands könnte zu einem Teufelskreis führen, in dem oxidativer Stress, Gerinnung und Gefäßpathologie sich gegenseitig positiv beeinflussen und die Neurodegeneration fördern.
Referenz:
Dr. Katerina Akassoglou ist Senior Investigator an den Gladstone Instituten und Professorin für Neurologie an der University of California (UC) in San Francisco. Sie hat Pionierarbeit zu den Mechanismen geleistet, die die Kommunikation zwischen Gehirn, Immunsystem und Gefäßsystem steuern.
Oxidative Desaminierung von Monoaminen
wird durch Monoaminoxidasen (MAO A und MAO B) katalysiert
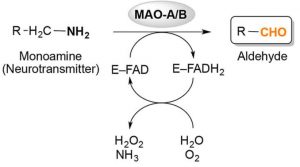
Abb. Oxidative Desaminierung von Monoaminen, katalysiert durch Monoaminoxidasen (MAOs) A und B. Allgemeines Reaktionsschema, das die Bindung eines Monoamins (Neurotransmitters) an das Flavoenzym (E-FAD) zum jeweiligen Aldehyd und Ammoniak durch Reduktion des Flavins Adenindinukleotid (FAD) -Cofaktor zu FADH2 zeigt.
Die bei der oxidativen Desaminierung entstehenden Hydroxylradikale zerfallen innerhalb von Nanosekunden und können Kettenreaktionen mit Bildung freier Radikale in Gang setzen. Das führt in Membran- oder Lipoproteinnähe zum Angriff auf die Fettsäureseitenkette der Phospholipide. Hier werden, indem die freien Radikale mit Lipiden, DNA und Aminosäuren in den Proteinen reagieren, degenerative Prozesse ausgelöst. Dabei bildet sich Wasser und ein Radikal mit zentralem Kohlenstoffatom. Das Radikal reagiert mittels Sauerstoff zum Peroxyradikal weiter. Peroxyradikale sind reaktionsfreudig genug, um die Fettsäureseitenketten anzugreifen, so dass es zur eben genannten Kettenreaktion kommt, die auch als Lipidperoxidation bekannt ist.
S-Adenosyl-L-Methionin (Ademetionin)-Substitution



Qualitätskriterien
Die Produkte der Angewandten Epigenetik von NUGENIS enthalten S-Adenosyl-L-Methionin (Ademetionin) in präventiver Dosis, um eine DNA-Hypomethylierung vorzubeugen und damit die sich ergebenden schwerwiegenden Schäden für den Organismus zu verhindern.
Die ausgewogene Zugabe von Vitamin B12, Vitamin B6 und Folsäure mindert die Gefahr einer Hyperhomocysteinämie.
Durch den hohen (S,S)–S-Adenosyl-L-Methionin (Ademetionin)-Anteil = aktive Form des S-Adenosyl-L-Methionin (Ademetionin) wird seine biologische Wirkung garantiert.
S-Adenosyl-L-Methionin (Ademetionin) wird bei der Einnahme vor dem Zugriff der Magensäure geschützt. Erstens durch eine magensaft-resistente Kapsel und zweitens als säurefestes gecoatetes S-Adenosyl-L-Methionin (Ademetionin)-Granulat.
GESUND SEIN UND GESUND BLEIBEN
S-Adenosyl-L-Methionin (Ademetionin) und Epigenetik –
– 1.Teil: Die metabolische Vielfältigkeit von S-Adenosylmethionin (Ademetionin)
– 3.Teil: DNA-Methylierung und andere epigenetische Werkzeuge
– 4.Teil: Die durch S-Adenosyl-L-Methionin (Ademetionin) – Mangel induzierte DNA-Untermethylierung und die sogenannten „Volkskrankheiten“
Ihr Eduard Rappold
