SPERMIDIN und EPIGENETIK der AUTOPHAGIE
SPERMIDIN und EPIGENETIK der AUTOPHAGIE
Spermidin ist es dafür bekannt, die Proteinbildung über mRNA-Stabilisierung zu fördern, die Stickoxidsynthase(NOS) zu hemmen und die Autophagie zu induzieren.
Wechselwirkung zwischen Alterung, Autophagie und Redoxhomöostase
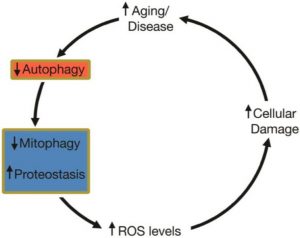
Ein theoretisches Modell, bei dem ein altersabhängiger Rückgang der Autophagie zu einem Anstieg der ROS führt, der zur Erhöhung des Zell- / Organschadens beiträgt.
Referenz: Yan Y, Finkel T. Autophagy as a regulator of cardiovascular redox homeostasis. Free Radic Biol Med. 2017; 109:108–113.
„Epigenetische Diäten“, wie Spermidin und grüner Tee und Butterschmalz als HDAC-Hemmstoffe fördern die Autophagie.
Seneszenz (Altern) ist mit einer verminderten Autophagie verbunden.
Epigenetische Kontrolle der Autophagie
In letzter Zeit ist die Rolle epigenetischer Mechanismen bei der Regulierung der Autophagie in den Vordergrund der Forschung gerückt. Mehrere Studien stützen die Rolle der epigenetischen Mechanismen, wie DNA – Methylierung und Histonmodifikation bei der Regulation der Autophagie.
Es wurden mehrere Histonmodifikationen mit der Regulation der Autophagie in Verbindung gebracht. Histone können durch eine Reihe von Enzymen modifiziert werden, die ihre Phosphorylierung, Methylierung, Acetylierung oder Ubiquitinierung induzieren. Es ist bekannt, dass diese Modifikationen oder „Histonmarkierungen“ die Struktur und die Genexpression des Chromatins beeinflussen. Es wurde gezeigt, dass die Monoubiquitinierung von Histon H2B eine Rolle bei der Regulation der Autophagie spielt. Als Ubiquitinierung bezeichnet man die Übertragung von Ubiquitin auf ein Zielmolekül. Der Verlust der H2B-Monoubiquitinierung führt zu einer erhöhten Autophagierate. In Übereinstimmung mit dieser Feststellung ist außerdem eine verringerte Nährstoffverfügbarkeit mit einer Verringerung der H2B-Monoubiquitinierung verbunden.
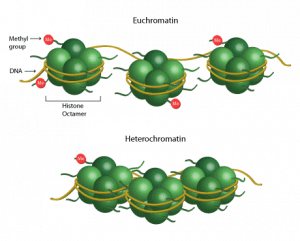
Insgesamt unterstreichen diese Erkenntnisse die Bedeutung der nuklearen Mechanismen für die Regulation der Autophagie.
Histonmodifikationen und epigenetischwirksame Enzyme im Zusammenhang mit der Regulation der Autophagie
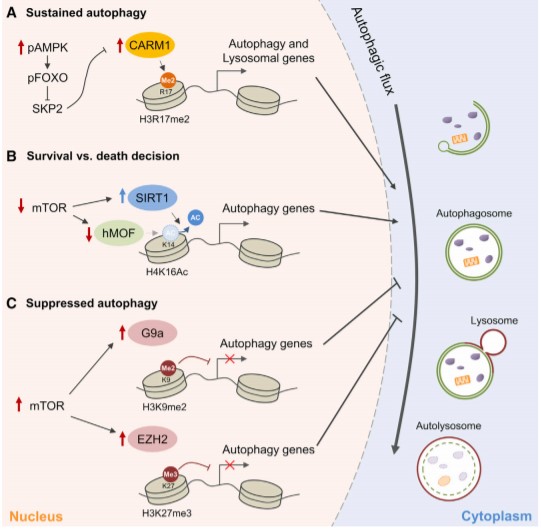
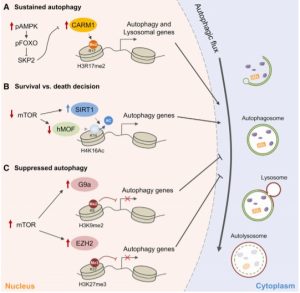 A Dargestellt sind autophagische Histonmodifikationen und verantwortliche epigenetische Enzyme. CARM1-abhängige H3R17 – Dimethylierungsfunktionen bei nachhaltiger Autophagie.
A Dargestellt sind autophagische Histonmodifikationen und verantwortliche epigenetische Enzyme. CARM1-abhängige H3R17 – Dimethylierungsfunktionen bei nachhaltiger Autophagie.
B Autophagische Leben-/Tod-Entscheidung über die hMOF-SIRT1-Kontrolle von H4K16-Acetylierung wurde identifiziert.
C H3K9-Dimethylierung durch G9a und H3K27-Trimethylierung durch EZH2 sind Unterdrückungsmarkierungen für die Autophagie.
Adaptive Immunität: Autophagie als Effektorarm des Immunsystems
Autophagie ist ein intrazellulärer homöostatischer Mechanismus, der für den Abbau von Abfallbestandteilen aus dem Zytoplasma in sauren lysosomalen Kompartimenten wichtig ist.
Ursprünglich wurde angenommen, dass überschüssige Teile des Zytoplasmas, die als Ziele für die Autophagie fungierten, zelluläre Organellen und Proteine umfassen. Dies hat sich nun auf eine Reihe von Krankheitserregern ausgeweitet, wobei der Schwerpunkt auf intrazellulären Bakterien liegt.
Die Erkenntnis, dass Autophagie intrazelluläre Bakterien binden und deren Zerstörung vermitteln kann, hat der Autophagie die Tür zu einer umfassenderen Rolle als Effektorarm des Immunsystems geöffnet.
Bei der angeborenen Immunität wirkt die Autophagie stromabwärts von Mustererkennungsrezeptoren, wo sie eine Reihe von Effektorreaktionen erleichtert, einschließlich der Zytokinproduktion und der Phagozytose.
Die Autophagie ist auch in der Lage, angeborene und adaptive Immunitätswege zu kreuzen, indem sie Antigene für die Antigenpräsentation abgeben kann.
Die Autophagie stellt eine wesentliche Quelle für Antigene zum Laden auf MHC-Klasse-II-Moleküle bereit. MHC-Klasse-II-Komplexe werden von spezialisierten Zellen des Immunsystems, so genannten professionellen Antigen-präsentierenden Zellen (antigen presenting cells, APC), präsentiert und von T-Helferzellen (CD4+ T-Zellen) erkannt. APC´s kommen unter anderem auf der Zellmembran von Makrophagen, B-Lymphozyten und dendritischen Zellen vor. Die Aktivierung und Differenzierung zu reifen dendritischen Zellen erfolgt erst nach Kontakt mit dem Antigen. Nach der Aufnahme von Antigenen über Phagozytose wandern sie in die regionären Lymphknoten. Dendritische Zellen präsentieren Antigene, vor allem den T-Lymphozyten.
APC´s können in dendritischen Zellen für das Cross-Priming auf CD8 (+) T-Zellen wichtig sein. Cross-Priming ist die Fähigkeit bestimmter Antigen-präsentierender Zellen, extrazelluläre Antigene mit MHC-Klasse-I-Molekülen aufzunehmen, zu verarbeiten und CD8-T-Zellen zu präsentieren.
In Lymphozyten ist die Autophagie für das Überleben und die Homöostase der Zellen von wesentlicher Bedeutung, insbesondere in T-Zellen.
Im Thymus kann die Autophagie die Selektion bestimmter D4 (+) – T-Zellklone modulieren (der CD4-Rezeptor oder einfach nur CD4 ist ein Glykoprotein, das an der Oberfläche von Zellen des Immunsystems vorkommt), während im Knochenmark die Autophagie für die Entwicklung von B-Zellen in bestimmten Stadien benötigt wird.
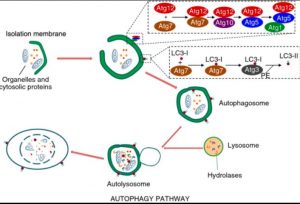
Abb. Schematische Darstellung des Autophagiepfades
Während der Autophagie sind zytoplasmatische Bestandteile in einer Isolationsmembran eingeschlossen, die hauptsächlich durch die Wirkung von zwei Ubiquitin-ähnlichen Konjugationssystemen zu einem doppelmembranisierten Autophagosom verlängert wird.
Autophagosomen fusionieren mit Lysosomen zu Autolysosomen, bei denen der Abbau des Vesikelinhalts zusammen mit der inneren Membran des Autophagosoms stattfindet.
Ihr Eduard Rappold
Alles was Sie über Ademetionin wissen sollten
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
www.spermidine-soyup.com
