Epigenetik und Zellgesundheit
Ademetionin und Spermidin als Meilensteine der Zellgesundheit
Zellgesundheit ist unser höchstes körperliches Gut. Es bedeutet, dass ein Zustand der Jugend für die Zelle und für den gesamten Organismus möglichst lange erhalten bleibt. Zelluläre Vitalität, eine gute Gesundheit und Langlebigkeit des Organismus sind damit unmittelbar verbunden.
Dem stehen entgegen: „Growing old: the most common mitochondrial disease of all?“ und der vom Alter abhängige Ademetionin (S-Adenosyl-L-Methionin) – Mangel und die vom Ademetionin (S-Adenosyl-L-Methionin) abhängige Biosynthese von Spermidin mit konsekutivem altersabhängigen Spermidin-Mangel.
Ademetionin (S-Adenosyl-L-Methionin) dient als singulärer Methylgruppendonator bei der Transmethylierung von DNA, RNA, Protein, Lipiden, Polysacchariden und der Produktion von Sekundärmetaboliten (siehe unten: Metabolische Vielseitigkeit von S-Adenosyl-L-Methionin = Ademetionin)
Ademetionin (S-Adenosyl-L-Methionin) ist auch an der Gentranskription und Zellproliferation beteiligt.
Ademetionin-(S-Adenosyl-L-Methionin) -Mangel führt zu vermehrter oxidativer Stressbelastung (ROS und RNS) der Zellen. Diese oxidative Stressbelastung wird durch oxidative Desaminierung von Gehirnbotenstoffen auf Grund überschießender Monoamin-Oxidasen (MAO’s)-Expression bei Hypomethylierung ihrer Genorte verursacht. Die oxidative Stressbelastung begünstigt die Entstehung zahlreicher Erkrankungen. Auch der Alterungsprozess führt im Laufe des Lebens zu akkumulierenden oxidativen Zellschäden.
Damit wird die besondere Vulnerabilität des Nervengewebes gegenüber oxidativem Zellstress zum einen durch die unzureichende Fähigkeit der Neurone zur Regeneration und zum anderen durch deren hohe Stoffwechselaktivität und die damit verbundene erhöhte endogene ROS-und RNS-Produktion erklärt. Neurodegenerative Erkrankungen sind die Folge.
Das Mitochondrium ist die Schlüsselorganelle für die Zellgesundheit, denn Mitochondrien sind die wichtigsten Energielieferanten für die Zellen, denn an der inneren Mitochondrienmembran findet sich die Atmungskette zur Produktion des Energieträgers ATP. Mitochondrien chatten mit dem Endoplasmatischen Retikulum, dem Ort der Proteinsynthese und mit den Membransystemen der Autophagie und des vakuolären Substrattransportes in den Zellen.
Das Mitochondrium ist unmittelbar durch vermehrte oxidative Stressbelastung betroffen, da es in seinen beiden Membranen die Monoamin-Oxidasen (MAOA und MAOB) verankert hat. Ein oxidativer Angriff auf die Struktur der Großmoleküle der Zelle, wie DNA, RNA, Proteine, Atmungsketten-Proteine und Phospholipide, ist die Folge. Das stört zuerst die Zellvitalität und zerstört schlussendlich die Zelle als Ganzes.
Drei Hauptmerkmale zeichnen die epigenetischen Modifikationen der DNA aus:
1) Sie werden durch Umwelteinflüsse (Exposom) verursacht
2) Sie sind zeitlich begrenzt vererbbar, zumindest über drei Generationen
3) Sie sind lebenslang dynamisch und potentiell reversibel
Die Modifikation der DNA ist heute als einer der Basismechanismen der Epigenetik bekannt. So definiert sich auch die Epigenetik als die „Gesamtheit der übertragbaren und reversiblen Veränderungen der Genexpression, die keine Veränderung der DNA und RNA einschließen“.
Große Meta-Studien zeigen, dass 10 bis 30 Prozent des Risikos für eine chronische Krankheit vom Genom (vererbbar) determiniert ist, während der Rest durch Umwelteinflüsse (zeitlich begrenzt vererbbar) im weitesten Sinne verursacht wird.
Alle diese externen Faktoren werden zusammenfassend als Exposom bezeichnet.
Der Begriff Exposom setzt sich aus expose (aussetzen) und Genom (Gesamtheit unserer Gene) zusammen. Es geht dabei also um alle äußeren Faktoren, die ein bestimmtes Maß an Einfluss auf genetisches Material, um ein Protein zu exprimieren oder stummzuschalten, ausüben können.
Eine erhöhte Spermidin-Synthese ist ein Notfallsprogramm für die Zellgesundheit, als Versuch, den zytotoxischen Folgen des oxydativen Zellstress (ROS) und des neuronalen Zellstress (Prolactin- und Cortisol-Erhöhung) durch Induktion der Autophagie entlastend entgegen zuwirken.
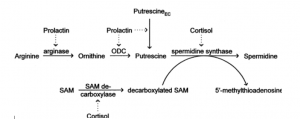
Abb. Stress und Spermidin-Synthese
Toxischer Stress führt auch zu Hypomethylierung des Glucocortcoid – Rezeptor – Genortes und damit zu erhöhter MaoB- Expression.
Toxischer Stress hemmt die Neurogenese und fördert die „synaptischen Serotonin-Mangel-Krankheiten“: Angst, Zwang, toxischen Stress, Burnout, Depression und Sucht (Heroin, Alkohol oder Nikotin).
Zunahme der Expression des Serotonintransporter -Gens verursacht eine Zunahme der Anzahl von Serotonin-Transportern. Mit mehr Serotonin-Transportern wird mehr Serotonin in die Präsynapse wiederaufgenommen, förmlich aus dem synaptischen Spalt in die Präsynapse „abgesaugt“, was letztendlich zu einer Verringerung von Serotonin im synaptischen Spalt führt.
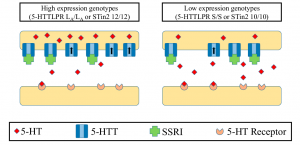
Abb. Serotonin-Transporter (SLC6A4) – Polymorphismen. Zwei polymorphe Stellen mit den Bezeichnungen 5-HTTLPR und STin2 haben funktionelle Konsequenzen.
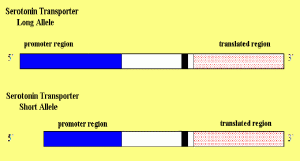
Abb.: Der Unterschied zwischen beiden Serotonin-Transportern liegt nicht in der Information zur Herstellung des Transporters selbst (der „translatierenden Region“), sondern in dem Teil des Gens, der steuert, wie oft die translatierende Region gelesen wird, nämlich der „Promotorregion“.
Diese Varianten des Serotonin-Transporter- Gens beeinflussen Persönlichkeitsmerkmale und psychiatrische Erkrankungen.
Serotonin und Dopamin sind wichtige Botenstoffe im Gehirn. Nervenzellen schütten sie an Synapsen aus und steuern darüber die Stimmung (Euphorie) und Verhalten.
Neue Studien zeigen, dass Serotonin und Dopamin auch an eine bestimmten Stelle des Histons H3 in den Zellkern gelangen und dort als epigenetische Marker die Aktivität bestimmter Gene durch Dopaminylierung und Serotonylierung beeinflussen können.
Referenz: Farrelly LA et al. Histone serotonylation is a permissive modification that enhances TFIID binding to H3K4me3. Nature. 2019 Mar;567(7749):535-539.
Cortisol fördert die Monoaminooxidasen-Expression. Der resultierende Dopamin-Mangel aus der oxidativen Desaminierung erhöht die Prolactin-Produktion, da die hemmende Wirkung von Dopamin auf die Prolactin-Produktion wegfällt.
Das Relaxpeptid Oxytocin wirkt dem Stress entgegen.
Ademetionin- und Spermidin- Biosynthese sind vom Lebensalter abhängig
Der Ademetionin (S-Adenosyl-L-Methionin) – Mangel ist vom Lebensalter abhängig. Um das 35. Lebensjahr ist bereits die Ademetionin (S-Adenosyl-L-Methionin)-Biosynthese um ein Drittel verringert und der Ademetionin (S-Adenosyl-L-Methionin) – Mangel gibt nicht mehr die Möglichkeit, die Überexpression der Monoamin-Oxidasen in den Mitochondrien zu verhindern. So begünstigt die zytotoxisch wirkende oxidative Stressbelastung aus der oxidativen Desaminierung der monoaminergen Gehirnbotenstoffe allmählich die Entstehung zahlreicher Krankheiten.
Die Spermidin-Biosynthese erfolgt durch Ademetionin (S-Adenosyl-L-Methionin) mittels Aminopropylation im C1-Zyklus und ist ebenso bereits um das 35. Lebensjahr um ein Drittel verringert.
Wege zur Zellgesundheit
- Eine bedarfsdeckende und altersabhängige Ademetionin (S-Adenosyl-L-Methionin)-Substitution für die Methylierung der DNA und der Histone führt zur Reduktion der zytotoxischen MAOA und MAOB-Überexpression.
- Serotonin, Dopamin, Noradrenalin und Histamin stehen als monoaminerge Botenstoffe zur Verfügung und können ihre Rezeptor-abhängigen Funktionen an den Synapsen optimal erfüllen. Monoamin-Neurotransmitter sind kritische Modulatoren für sexuelles und aggressives Verhalten. Dopamin erhöht die Flexibilität im Denken und die Motivation und fördert die Kreativität. Serotonin ist einer der bekanntesten Botenstoffe im menschlichen Körper, die glücklich machen.
- Eine zusätzliche Rezeptor- unabhängige Funktion der monaminergen Botenstoffe besteht darin, dass monoaminerge Neurotransmitter direkt mit der Erbsubstanz im Zellkern verknüpft werden (Histon-Monoaminylierung), eine entzugsbedingte Genexpression verhindert und das Suchtverhalten verringert werden.
- Auch eine Diabetes-Vorsorge wird möglich, da ein intrazellulärer Serotonin-Mangel in den Betazellen der Bauchspeicheldrüse verhindert und somit die reguläre Freisetzung von Insulin gesichert ist.
- Eine bedarfsdeckende und altersabhängige Ademetionin (S-Adenosyl-L-Methionin)-Substitution sichert die Spermidin-Biosynthese durch Aminopropylation im C1-Zyklus.
- Eine bedarfsdeckende und altersabhängige Ademetionin (S-Adenosyl-L-Methionin)-Substitution schützt die Mitochondrien indem weniger ROS -Abbauprodukte aus der oxidativen Desaminierung von Dopamin und anderer Monaminen zu Zytotoxizität und einer Apoptose-Induktion in den Mitochondrien führen.
- Eine bedarfsdeckende und altersabhängige Ademetionin (S-Adenosyl-L-Methionin)-Substitution sichert die Glutathion-Biosynthese durch Transsulfuration im C1-Zyklus. Glutathion ist das potenteste Antioxidans der Zelle.
- Eine bedarfsdeckende und altersabhängig Ademetionin (S-Adenosyl-L-Methionin)-Substitution schützt die Zellen vor ER-Stress (ER=Endoplasmatisches Retikulum) und ermöglicht eine reguläre Proteinsynthese.
- Eine bedarfsdeckende und altersabhängige Ademetionin (S-Adenosyl-L-Methionin)-Substitution induziert die Spermidin-Biosynthese, ermöglicht eine reguläre Membranogenese und fördert die Autophagie, die mit Autophagosomen nach Fusion mit Lysosomen, fehlgefaltete Proteine, Viren und Bakterien aus der Zelle ausschleust und den zellulären Substrattransport in Vakuolen.
- Zellgesundheit repräsentiert die jugendliche Unversehrtheit der Zelle. Zellgesundheit verzögert die Zellalterung als pathophysiologische Folge, die zu Schäden an den Zellbestandteilen führt, die Krankheiten verursachen.
- Präventive Ademetionin (S-Adenosyl-L-Methionin)-Substitution und die präventive Substitution von Spermidin sichern die Zellgesundheit.
Personalisierte Krankheitsprävention
Der Energieträger ATP, S-Adenosyl-L-Methionin (Ademetionin) und Spermidin sind Schlüsselmoleküle im intermediären Stoffwechsel
Die Genexpression ändert sich ständig, wird aber lifestyle-& altersabhängig durch die Abnahme der S-Adenosyl-L-Methionin-Produktion in der Leberzelle, dem altersabhängigen Ausmaß der Spermidin-Biosynthese und von Quantität und Qualität der Mitochondrien (Abnahme der ATP-Produktion) beeinflusst.
Angewandte Epigenetik ist im Wesen mehr als das Verständnis, dass Epigenetik ausschließlich unter dem Einfluss von Umwelt, wie dass die Exposition gegenüber Luftverschmutzung die epigenetischen Modifikationszustände verändert und Lebensstil, wie Ernährung, Sport und Stressvermeidung u.m. (Exposom) steht.
Eine personalisierte Krankheitsprävention bedarf des Wissens um den altersbedingten Mangel an Ademetionin (S-Adenosyl-L-Methionin) in seiner biologisch aktiven (S,S) Form und um den altersbedingten Mangel an Spermidin.
Schon um das 35.Lebensjahr kommt es zu einer merklichen Abnahme der Ademetionin (S-Adenosyl-L-Methionin)- Produktion in den Leberzellen. Um das 80. Lebensjahr reduziert sich die Ademetionin (S-Adenosyl-L-Methionin)-Produktion auf 2/3 seines Ausgangswertes in der Jugendzeit.
Für die Entwicklung eines Spermidin-Mangel gelten die selben Voraussetzungen, da Ademetionin (S-Adenosyl-L-Methionin) für die Biosynthese von Spermidin verantwortlich ist.
Fazit: Als Folge des Ademetionin (S-Adenosyl-L-Methionin)-Mangels kommt es zu einer Hypomethylierung der Genorte der Monoaminoxidasen A und B und zu erhöhter MAOA- und MAOB-Expression mit zytotoxischen Abbauprodukten der monoaminergen Neurotransmitter (ROS und NOS) aus der oxidativen Desaminierung,die die Quantität und Qualität der Mitochondrien und die ATP-Produktion störend beeinflussen und zum Zelluntergang führen.
Das heißt, dass sowohl Ademetionin (S-Adenosyl-L-Methionin) in seiner biologisch aktiven (S,S) Form als auch Spermidin altersabhängig substitutionspflichtig sind, um die Zellgesundheit zu erhalten.
Vorteile für den Organismus einer täglichen Einnahme von Ademetionin (S-Adenosyl-L-Methionin) in seiner biologisch aktiven (S,S) Form in präventiver Dosierung :
Metabolische Vielseitigkeit von S-Adenosyl-L-Methionin = Ademetionin
Transmethylierungen mit dem Methylgruppen-Donator S-Adenosyl-L-Methionin = Ademetionin finden sich im Intermediärstoffwechsel bei der Biosynthese folgender körpereigener Stoffe:
- Spermidin – Biosynthese
S-Adenosyl-L-Methionin = Ademetionin ist verantwortlich für die Spermidin – Biosynthese:
Im C1- Zyklus, bei der Amino-Propylation, ist das decarboxylierte S-Adenosyl-L-Methionin (DCSAM) auch als Aminopropylgruppendonator für die Bildung von Polyaminen bekannt. Aus Putrescin und decarboxyliertem S-Adenosyl-L-Methionin = Ademetionin entsteht Spermin und als seine Vorstufe Spermidin.
Spermidin ist an der Membranstabilisierung, Zellteilung und Zelldifferenzierung beteiligt und hilft wachsenden Zellen bei der Synthese von Nukleinsäuren und Proteinen. Demzufolge wirkt Spermidin stabilisierend auf die DNA. Spermidin induziert die Autophagie und sorgt so für die Entlastung der Zellen von zellbelastenden fehlgefaltenden Proteinen, Viren und Bakterien.
- Melatonin – Biosynthese für einen gesunden Schlaf und eine verbesserte Schlafarchitektur
Ademetionin (S-Adenosyl-L-Methionin) ist der Katalysator der körpereigenen Melatonin-Synthese.
Melatonin ist ein Hormon, das den Tag-Nacht-Rhythmus des menschlichen Körpers steuert; es entsteht aus der Methylierung von N-Acetylserotonin.
Mit dem “Timezyme”, Acetylserotonin-O-Methyltransferase, wird aus Serotonin zu N-Acetylserotonin, das mit Hilfe von S-Adenosyl-L-Methionin (Ademetionin) methyliert wird und es entsteht Melatonin.
S-Adenosyl-L-methionin (Ademetionin) + N-Acetylserotonin → S-Adenosyl-L-homocystein + Melatonin
Melatonin fördert die Neurogenese und die Neuroprotektion durch die Blockierung der Aβ-Produktion, Aβ-Oligomerisierung und -Fibrillation, Tau-Hyperphosphorylierung, synaptische Dysfunktion, oxidativen Stress und neuronalen Tod während der Alzheimer Krankheit-Progression.
- Adrenalin-Biosynthese
S-Adenosyl-L-Methionin = Ademetionin wirkt als Methyl-Gruppen-Spender bei der Adrenalin-Biosynthese:
Adrenalin ist ein im Nebennierenmark gebildetes und in Stresssituationen ins Blut ausgeschüttetes Hormon, das aus Noradrenalin durch Übertragung einer Methylgruppe entsteht. Als Katecholamin hat Adrenalin an den sympathischen Alpha- und Beta-Rezeptoren des Herzkreislaufsystems eine anregende Wirkung – es steigert u.a. den Blutdruck und erhöht die Herzfrequenz. Im Zentralnervensystem fungiert Adrenalin als Neurotransmitter.
- Glutathion-Biosynthese
Durch Transsulfurierung aus dem C1-Zyklus, dem Syntheseweg von S-Adenosyl-L-Methionin = Ademetionin, wird Glutathion, L-Glutamyl-L-cysteinylglycin, kurz GSH – ein Tripeptid, aus den Aminosäuren Glutaminsäure, Cystein und Glycin- gebildet.
Glutathion ist das wirksamste intrazelluläre Antioxidans. Als Substrat der Glutathionperoxidase ist Glutathion antioxidativ wirksam und schützt Zellen, Mitochondrien, DNA und andere Makromoleküle der Zelle vor oxidativen Schädigungen.
S-Adenosyl-L-Methionin (= Ademetionin)- Gabe führt zur Hemmung der Lipid- Wasserstoffperoxid- Produktion und verbessert das Glutathion- antioxidative System.
- Cholin-Biosynthese
S-Adenosyl-L-Methionin (= Ademetionin) ist der Methylgruppen- Spender bei der Cholin-Biosynthese.
Cholin – wird durch Methyl-Gruppenübertragung aus Ethanolamin synthetisiert. Als primärer, einwertiger Alkohol ist Cholin ein Strukturelement sowohl des Neurotransmitters Acetylcholin, Essigsäureester des Cholins, als auch von Lecithin beziehungsweise Phosphatidylcholin, der Phosphorsäureester des Cholins, das wesentlicher Bestandteil aller Biomembranen des Nervensystems ist. Zudem fungiert Cholin auch als Methylgruppendonator im Intermediärstoffwechsel. Bei S-Adenosyl-L-Methionin-Mangel stehen zu geringe Mengen an Cholin zur Synthese des wichtigen Neurotransmitters Acetylcholin zur Verfügung.
Acetylcholin ist einer der wichtigsten Neurotransmitter, also der Botenstoffe im Gehirn und des Parasympathischen Nervensystems. Es ist unter anderem verantwortlich für die Muskelkontraktion, da es die Übertragung zwischen Nerv und Muskel an den sogenannten neuromuskulären Endplatten vermittelt
- Biotin- und Liponsäure-Biosynthese
S-Adenosyl-L-Methionin (= Ademetionin) dient auch als Quelle für Schwefelatome bei der Synthese von Biotin und Liponsäure.
- Kreatin-Biosynthese
70% des vorhandenen S-Adenosyl-L-Methionin (= Ademetionin) fließt in die Kreatin-Synthese.
Kreatin, eine organische Säure, die infolge einer Transmethylierung aus Guanidinoacetat mit Hilfe der Methylgruppen-Donation von S-Adenosyl-L-Methionin (= Ademetionin) gebildet wird. In Form von Kreatinphosphat wird Kreatin für die Kontraktion der Muskulatur benötigt und trägt zur energetischen Versorgung der Muskeln bei.
- L-Carnitin-Biosynthese
Ausgangssubstanz für die Eigensynthese ist die essentielle Aminosäure Lysin, die in einer fünfstufigen Reaktionsfolge dreifach methyliert (durch Anhängen von CH3-Gruppen), mehrfach reduziert (Einfügen von Wasserstoff (H)-Atomen) und decarboxyliert (Abspaltung eines Kohlendioxid (CO2)-Moleküls) wird. Die CH3-Gruppen stammen aus S-Adenosyl-L-Methionin (Ademetionin).
L-Lysin → Trimethyllysin → Hydroxy-Trimethyllysin → Trimethylaminobutyraldehyd → Trimethylaminobutyrat (gamma-Butyrobetain) → L-Carnitin
L-Carnitin – Methionin führt zusammen mit Lysin zur Bildung von L-Carnitin, das eine Schlüsselrolle in der Regulation des Fett-, Kohlenhydrat- und Proteinstoffwechsels einnimmt. Mittelkettige Fettsäuren werden mittels Carnitin-Palmitoyltransferasen transmembranal in die Mitochondrien geschleußt und dienen zur Energieversorgung der Mitochondrien.
- Schutz vor DNA-Abbau
Die durch S-Adenosyl-L-Methionin (= Ademetionin) beim Transmethylierungsprozess methylierten Nukleinbasen der DNA und RNA bieten Schutz der DNA vor einem Abbau.
- Entgiftung von Arzneimitteln
S-Adenosyl-L-Methionin (= Ademetionin) methyliert Pharmaka und ermöglicht die Entgiftung von Arzneimitteln.
Riskofaktor im Alter: die Hypomethylierung von DNA
Es ist klar, dass das Altern das Epigenom des Menschen beeinflusst, einschließlich die Hypomethylierung von DNA (Erbsubstanz).
Die DNA-Methylierung ist ein entscheidender biologischer Prozess, der die Aufrechterhaltung der genomischen Integrität und die genaue Expression genetischer Informationen kontrolliert.
Der genaue Status der DNA-Methylierung ist in reifen Zellen ausgeglichen, aber mit zunehmendem Alter verschiebt sich dieses Gleichgewicht stark zugunsten der DNA-Demethylierung. Daher scheint die DNA-Hypomethylierung, die während des normalen Alterns auftritt, ein kritischer Risikofaktor zu sein.
S-Adenosyl-L-Methionin (Ademetionin) ist der wesentliche Methylgruppendonator für die nukleare DNA (nDNA) und mitochondriale DNA (mtDNA).
Es kommt bei S-Adenosyl-L-Methionin-Mangel zum Aktivitätsanstieg der MAOB durch vermehrte MAOB-Expression, per se um das 3 – 4-Fache im Alter, bei LOAD (late-onset Alzheimer’s disease) und bei der Depression im Alter.
DNA-Hypomethylierung bei Alterung, Immunsystem und Autoimmunität
Das angeborene Immunsystem des Menschen ist in der Lage, Krankheitserreger wie Viren, Bakterien oder Parasiten zu erkennen und unschädlich zu machen. Es erkennt diese Erreger unter anderem anhand ihrer RNA und DNA. Diese Nukleinsäuren existieren aber auch in menschlichen Zellen. Daher muss das Immunsystem in der Lage sein, körpereigene Substanzen von körperfremden zu unterscheiden, um Autoinflammation oder Autoimmunerkrankungen zu vermeiden. Das nennt man auch Self/Non-Self–Diskriminierung.
Die Methylierung der DNA ist verhindert die Aktivierung von zelleigenen Viren, den sogenannten Transposons, die ihre Position im Genom verändern können. Wenn das epigenetische Schlüsselenzym DNA-Methyltransferase 1 fehlt kommt es zu reduzierter DNA-Methylierung und zu Autoinflammation begleitet von pathologischen Veränderungen in der Haut.
Die epidermisspezifische DNA-Methyltransferase (DNMT) 1-Deletion stört stark die epidermale Struktur und die Homöostase und löst eine massive angeborene Immunantwort und die Infiltration von Immunzellen aus. Mechanistisch löst die DNA-Hypomethylierung in Keratinozyten eine Transposon-Derepression, (d. h. Wieder-Aktivierung von Genen durch Erhöhung der Rate der Transkription), mitotische Defekte und die Bildung von Mikronuklei aus. Die DNA-Freisetzung in das Zytosol von DNMT1-defizienten Keratinozyten aktivierte die Signalübertragung durch Cyclic GMP–AMP synthase (cGAS) und Stimulator of interferon genes (STING) und löste so eine Entzündung aus.
Eine derart reduzierte DNA-Methylierung verursacht aber nicht nur die Aktivierung von Transposons, sondern auch eine gewisse genomische Instabilität, die zum Auftreten von DNA außerhalb des Zellkerns (Mikronuclei) führt, Wenn sich Mikronuclei bilden, erkennt Cyclic GMP–AMP synthase (cGAS), einer der Hauptregulatoren des angeborenen Immunsystems, die DNA fälschlicherweise als fremd bzw. „non-self“ und aktiviert das Immunsystem.
Quelle: Beck MA, Fischer H, Grabner LM, Groffics T, Winter M, Tangermann S, Meischel T, Zaussinger-Haas B, Wagner P, Fischer C, Folie C, Arand J, Schöfer C, Ramsahoye B, Lagger S, Machat G, Eisenwort G, Schneider S, Podhornik A, Kothmayer M, Reichart U, Glösmann M, Tamir I, Mildner M, Sheibani-Tezerji R, Kenner L, Petzelbauer P, Egger G, Sibilia M, Ablasser A, Seiser C. DNA hypomethylation leads to cGAS-induced autoinflammation in the epidermis. EMBO J. 2021 Sep 29:e108234.
Auch die altersbedingten Veränderungen der DNA-Methylierung, insbesondere der DNA-Hypomethylierung haben sich als mechanistischer Zusammenhang zwischen Alterung und Autoimmunität herausgestellt. Hinweise aus In-vitro- und In-vivo-Modellen haben gezeigt, dass die DNA-Hypomethylierung möglicherweise an der Entwicklung der Autoimmunität beteiligt ist (Richardson 2002; Richardson 2003a).
Es wurde auch vorgeschlagen, dass die DNA-Methylierung eine wichtige Rolle bei der epigenetischen Regulation adaptiver Reaktionen des Immunsystems spielt, und es wurde festgestellt, dass Gene, die für die T-Zell-Differenzierung wichtig sind, durch epigenetische Prozesse während des Alterns unterschiedlich exprimiert werden.
Außerdem scheint die altersbedingte Demethylierung auf die Immunkompetenz und die Häufigkeit der Autoimmunität bei älteren Menschen Einfluss zu nehmen und kann zu Krankheiten wie rheumatoider Arthritis beitragen.
Stressbedingte vorzeitige Seneszenz durch MAOA-Expression
Die zelluläre Seneszenz, der in somatischen Zellen beobachtete irreversible Zellzyklusstillstand, ist ein wichtiger Treiber für altersassoziierte Krankheiten. Mitochondrien sind in den Seneszenzprozess verwickelt, hauptsächlich, weil sie sowohl Quellen als auch Ziele von reaktiven Sauerstoffspezies (ROS) sind.
Das mitochondriale Enzym Monoaminoxidase-A (MAOA) ist eine relevante Quelle für ROS im Herzen durch die Bildung von H2O2, das aus dem Abbau (oxidativer Desaminierung) seiner Hauptsubstrate Noradrenalin und Serotonin stammt.
Schutz des Gelenksknorpels und der Bandscheiben durch S-Adenosyl-L-Methionin (Ademetionin)
Es ist wahrscheinlich, dass die DNA-Methylierung bei Arthrose, einer typischen Alterskrankheit, wichtig ist. Die mit zunehmendem Alter auftretenden Aberrationen der DNA-Methylierung können auch hier die Expression einer Reihe von Genen beeinflussen, die zur Arthrose beitragen.
Studien zeigen, dass S-Adenosyl-L-Methionin (Ademetionin) die Chondrozyten-Proteoglykansynthese und deren Proliferationsrate erhöht. S-Adenosyl-L-Methionin (Ademetionin) ist für die Biosynthese von Polyaminen (wie Spermidin) notwendig. Spermidin und Spermin stabilisieren die polyanionischen Makromoleküle von Proteoglykanen und schützen sie dadurch vor dem Angriff von proteolytischen und glykolytische Enzymen. Mit S-Adenosyl-L-Methionin (Ademetionin) werden die Basalbedingungen an den Synovialzellen nach Zytokin-induzierter Zellschädigung wiederhergestellt.
S-Adenosyl-L-Methionin (Ademetionin) als Schmerzmittel (Analgetikum) bei Arthrosen, Fibromyalgie und Migraine
Schwache Schmerzmittel erhöhen den Blutdruck. Sie verursachen auch Nierenschäden und Magengeschwüre und sind eine der häufigsten Nebenwirkungen bei der Einnahme von Schmerzmitteln vom Typ der NSAID`s (non-steroidal anti-inflammatory drugs).
Jährlich sterben in Österreich schätzungsweise 400 und in Deutschland 1100 bis 2200 Menschen an den Folgen von unerwünschten kardiovaskulären und gastrointestinalen Arzneimittelnebenwirkungen von NSAID´s .
Das ist mit ein Beispiel, dass Medikamente, einen nicht enden-wollender Kreislauf an Behandlung und Nebenwirkungen, die wiederum Behandlung brauchen und noch mehr Nebenwirkungen verursachen, verursachen.
Der Vorzug von S-Adenosyl-L-Methionin (Ademetionin) als Schmerzmittel gegenüber den „nichtsteroidalen Antirheumatika“ (NSAR) ist wissenschaftlich bewiesen.
Studienbeurteilung durch COCHRANE: S-Adenosyl-L-Methionin (Ademetionin) hat einen bescheidenen, aber signifikanten Vorteil im Vergleich zu Placebo und hat dieselbe Wirksamkeit wie die NSAID’s.
Beteiligung der DNA-Hypomethylierung an der Pathogenese von altersbedingter Makuladegeneration
Die altersbedingte Makuladegeneration (AMD) ist die häufigste Ursache für eine irreversible Blindheit bei Menschen ab 50 Jahren und kann nicht wirksam geheilt werden. Die Krankheit ist gekennzeichnet durch die fokale Ablagerung von azellulären polymorphen Trümmern, Drusen genannt, zwischen retinalem Pigmentepithel (RPE) und Bruch-Membran.
Eines der in Drusen akkumulierten Hauptproteine ist Clusterin, dessen Expression durch Promotormethylierung reguliert wird. Jüngste Ergebnisse, die zeigen, dass die Behandlung der RPE-Zelllinie mit 5-Aza–2′-desoxycytidin (Decitabin) einem DNA-Methyltransferase-Inhibitor (demethylierende Substanz) die Clusterininduktion und -sekretion auf Medium potenziert, lieferten einen zusätzlichen Beweis für die Beteiligung der DNA-Hypomethylierung an der Pathogenese von AMD.
DNA-Untermethylierung bei S-Adenosyl-L-Methionin-(Ademetionin-) Mangel spielt eine wichtige Rolle bei der Alzheimer-Krankheit
Der S-Adenosyl-L-Methionin (Ademetionin) – Mangel
bei der Entstehung der Alzheimer-Krankheit
Ein S-Adenosyl-L-Methionin (Ademetionin) – Mangel führt zu Hypomethylierung (mangelhafte Versorgung mit Methyl-Gruppen) der Gen-Orte am Genom (Erbsubstanz) und zur Expression von Alzheimer-induzierenden Proteinen.
Alzheimer-induzierende Proteine als Ursache der Tau- und Amyloid-Pathologie:
- DSCAML1-Gen (Down syndrome cell adhesion molecule-like protein 1) -Gen exprimiert ein Protein im sich entwickelnden Nervensystem, wobei der höchste Expressionsgrad im fötalen Gehirn auftritt. Eine Überexpression des Proteins im sich entwickelnden fetalen Zentralnervensystem führt zum Down-Syndrom.
- BACE1 (Beta-Site-Amyloid-Vorläuferprotein-spaltendes Enzym 1) ist für die Erzeugung aller monomeren Formen von Amyloid-β (Aβ) einschließlich Aβ 42 erforderlich. Die BACE1-Konzentrationen und -Aktivitätsraten sind in Alzheimer-Gehirnen und Körperflüssigkeiten erhöht, was die Hypothese stützt, dass BACE1 eine entscheidende Rolle in der Alzheimer-Pathogenese spielt.
- Presenilin-1 ist ein Presenilin-Protein, das beim Menschen vom PSEN1-Gen kodiert wird. Presenilin-1 ist eines der vier Kernproteine im Gamma-Sekretasekomplex, von dem angenommen wird, dass es eine wichtige Rolle bei der Erzeugung von Amyloid Beta aus Amyloid-Vorläuferprotein (APP) spielt.
- MaoB und MaoA (MAOB-und MAOA-Gen) Monoaminoxidasen sind mitochondriale Enzyme, die Monoamine durch Desaminierung mit Hilfe von H₂O und O₂ zu den entsprechenden Aldehyden, Ammoniak und Wasserstoffperoxid abbauen,
- erhöhte Expression von MaoB und MaoA bei Hypomethylierung ihrer Genorte sind der Anlass für die Bildung von reaktiven Sauerstoffspezies (ROS) . Die Belastung durch „Sauerstoffradikale“ und hochreaktive Stickstoffverbindungen leiten die Neurodegeneration ein,
- erhöhte Expression von MaoB und MaoA bei Hypomethylierung ihrer Genorte sind die Ursache der mitochondrialen Dysfunktion,
- erhöhte Expression von MaoB und MaoA bei Hypomethylierung ihrer Genorte sind ursächlich für die TAU-Pathologie (AT8-ir Pathologie): Die Bildung von neurofibrillären Tangles unter oxidativem Zellstress beginnt vor der Pubertät oder im frühen jungen Erwachsenenalter in ausgewählten subkortikalen Kernen und nicht in der Großhirnrinde.
- Die Entwicklung der TAU-Pathologie geht der Entwicklung der Amyloid-β-Pathologie um drei Jahrzehnte voraus.

- am rauen endoplasmatischen Retikulum stört eine erhöhte MAOB und MAOA – Expression die Biosynthese der Proteine (Translation) und
- erhöhte MAOB und MAOA behindern den Autophagie-Prozess durch Alteration der Lysosomen.
- Eine erhöhte MaoB und MaoA in den protoplasmatischen Astrozyten sind die Auslöser der Bluthirnschranken-Dysregulation und der darauf folgenden Neuroinflammation.
Bluthirnschranken-Dysregulation und Neuroinflammation
Die Bluthirnschranke, brain–blood barrier (BBB) = neurovaskulären Einheit (NVU), ist wie eine Trennwand zwischen den Blutgefäßen und den Gehirnzellen (Neurone und Gliazellen). Sie ist wichtig, um die Bedingungen im Gehirn möglichst gleich zu halten.
Mikrovaskuläre Endothelzellen bilden Monoschichten, die ein integraler Teil der hochspezialisierten Bluthirnschranke sind. Mikrovaskuläre Endothelzellen sind durch Junctional-Proteine an einer Basalmembran befestigt und verschaltet. Zusammen mit mesenchymartigen Zellen, den Perizyten, glatten Muskelzellen, Astrozyten mit Endfeet-Fortsätzen und zirkulierenden Blutzellen bauen sie die sogenannte neurovaskulären Einheit.
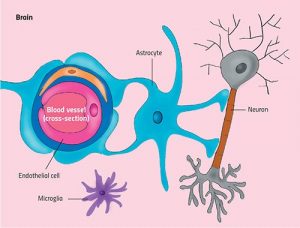
Abb. Gehirnendothelzellen bilden gemeinsam mit Neuronen und anderen spezialisierten Zellen (z.B. Ependymzelle, Neuron, Oligodendrozyt, Astrozyt, Mikroglia) ein interaktives Netzwerk, das als neurovaskuläre Einheit (NVU) bezeichnet wird.
Quelle: Neuwelt, E. A., et al. Engaging neuroscience to advance translational research in brain barrier biology. Nature reviews. Neuroscience. 169-182 (2011).
Die neurovaskuläre Einheit (NVU) ist eine dynamische, hoch spezifische und geregelte Schnittstelle, die den Übergang von Fluiden, Moleküle und Zellen zwischen zerebralen Blutgefäßen und dem ZNS steuert.
Eine Dysregulation der neurovaskulären Einheit kann zu einer Vielzahl von neurovaskulären, infektiösen, entzündlichen oder degenerativen Erkrankungen des ZNS, wie beispielsweise Schlaganfall, HIV-Enzephalopathie, multiple Sklerose, Morbus Alzheimer oder Morbus Parkinson, beitragen.
Protoplasmatische Astrozyten sind für die Bildung und Aufrechterhaltung der Bluthirnschranke unerlässlich, indem sie Faktoren bereitstellen, die zu einer adäquaten Verbindung zwischen den Zellen der Bluthirnschranke und der Bildung starker Tight Junctions führen.
Protoplasmatische Astrozyten und Perizyten umkreisen Endothelzellen direkt und helfen nicht nur, die Blutversorgung mit dem Stoffwechselbedarf zu verknüpfen, sondern scheiden auch eine Reihe von Molekülen aus, die die BBB-Integrität verbessern und aufrechterhalten.
Protoplasmatische Astrozyten stellen durch ihre Endfüße die Verbindung zwischen den Inhaltsstoffen im Blutfluss des Endothels und den Neuronen her und sind so wichtige Regulatoren bei der Bildung und Aufrechterhaltung der neurovaskulären Einheit.
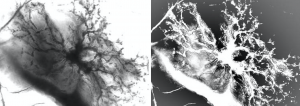
Abb. protoplasmatischer Astrozyt mit Endfüßen im orbitofrontalen Kortex des menschlichen Gehirns
Eine erhöhte Monoaminooxidase B (MAOB) in den protoplasmatischen Astrozyten führt bei Alzheimer-Krankheit und anderen neurodegenerativen Erkrankungen, z.B: der Parkinson Krankheit, zu zytotoxischen Dopaminabbauprodukten und in Folge zum Zelluntergang der protoplasmatischen Astrozyten. Damit fällt die Steuerungsfunktion des protoplasmatischen Astrozyten für die Hirnkapillarendothelzellen aus.
Damit ist auch erklärt, dass der anfängliche Kontakt der Mikroglia mit zerebralen Blutgefäßen tatsächlich die Integrität der BHS schützt. Aber eine weiter anhaltende Entzündung führt zu einer Dominanz eines stärker aktivierten mikroglialen Phänotyps, was zu einer Phagozytose der Astrozytenendfüße, bei anhaltender Alteration des protoplasmatischen Astrozyten durch gliatoxische Abbauprodukte aus der oxidativen Desamination von monoaminergen Neurotransmittern durch Monaminoxidasen (MAOB und MAOA), und schlussendlich zu einem Verlust der BBB-Permeabilität, führt.
Referenz: Haruwaka, K., Ikegami, A., Tachibana, Y. et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nat Commun 10, 5816 (2019).
Die Stummschaltung von MAO B – Expression mit S-Adenosyl-L-Methionin (Ademetiomin) schützt vor dieser zellzerstörenden endogenen Bioaktivierung, die den protoplasmatischen Astrozyten betrifft, der damit seine regulatorische Funktion auf die BBB-Permeabilität verliert und die Durchlässigkeit der neurovaskulären Einhei für Fluids, Moleküle und Zellen wird erhöht.
Eine gestörte Regulation der neurovaskulären Einheit kann zu Amyloid-Ablagerungen im Gehirn führen
Bei einem Gehirntrauma werden gleichzeitig Astrozyten und Mikroglia aktiviert, was die Freisetzung von Zytokinen fördert, was wiederum die Endothelial Tight Junctions und die Pericyten beeinflusst und die Durchlässigkeit der neurovaskulären Einheit (NVU) für Fluids, Moleküle und Zellen erhöht.
Bei Alzheimer Krankheit finden sich zerebrale Amyloidangiopathien bzw. zerebrovaskuläre Amyloidosen und auch ausgedehnte Amyloid-Ablagerungen in der Groß- und Kleinhirnrinde (senile Plaques sind Ablagerungen aus verklumpten Aβ-Peptiden im Neuropil).
Es wird vermutet, dass der Eintritt von Proteinvorstufen über die neurovaskuläre Einheit aus dem Serum in das Gehirn bei der Alzheimer-Erkrankung zu Amyloid-Ablagerungen im Gehirn führt.
Die Vorteile für den Organismus einer täglichen Einnahme von Spermidin :
- Spermidin ist ein wichtiger Wachstumsfaktor
Spermidin ist ein wichtiger Wachstumsfaktor, der eine entscheidende Rolle bei der Stabilität von Messenger-RNAs (mRNAs) und so auch Einfluss auf die Translation (Proteinsynthese), RNA-Bindung, RNA-Synthese, RNA-Synthese-Komplex und Regulation des Membranpotentials einnimmt.
- Spermidin-induziert die Autophagie
Autophagie als Erleichterungsprogramm für die Zelle schützt die Zellgesundheit in einem physiologischen Bereich (oxidativer Eustress) vor den Folgen des „Elektronen-Leck’s“.
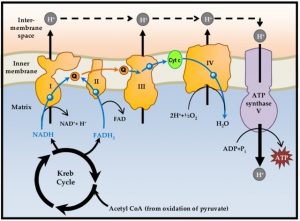
Abb: Schematischer Überblick über die Physiologie der Atmungskette
Es können nicht alle Elektronen die Atmungskette vollständig durchlaufen. Durch ein sogenanntes „Elektronen-Leck“ an Komplex I und III können 1-3% der Elektronen entweichen und direkt mit Sauerstoff reagieren.
Es wird zwischen oxidativer Eustress (was im Großen und Ganzen dem ROS-Signal entspricht) und toxischem oxidativen Stress, was im Großen und Ganzen einem viel höheren ROS-Level entspricht, unterscheiden, was letztendlich in vielen Fällen zu einer Reihe von Ereignissen führt, die zum Zelltod führen können.
Referenzen:
Sies H. Hydrogen peroxide as a central redox signaling molecule in physiological oxidative stress: oxidative eustress. Redox Biol. 2017; 11:613–9.
Sies H, Berndt C, Jones DP. Oxidativen Stress. Annu Rev Biochem. 2017; 86: 715–48.
Mit einem zellulären Notfallprogramm, der Autophagie, unterstützt Spermidin als potenter Autophagie-Induktor die Zellen dabei, Zellmüll zu entsorgen und entlastet so die Zellen von toxischen Inhalten und die entlasteten Zellen bleiben länger funktionsfähig, was in Summe einem Anti Aging-Effekt entspricht. So schützt auch Spermidin vor dem Altern.
-
Spermidin hilft bei der Aufrechterhaltung der Proteinhomöostase
Spermidininduzierte Autophagie trägt zur Aufrechterhaltung der Proteinhomöostase, also eines Gleichgewichts zwischen Synthese, Faltung und kontrolliertem Abbau von Proteinen, bei.
Spermidin kann neusynthetisierten Proteinen „helfen“ sich korrekt zu falten und entlastet damit das Ubiquitin-Proteasom-System und den Prozess der Autophagie.
Die Entfernung fehlgefalteter, geschädigter, dysfunktionaler oder aggregierter Proteine kann grundsätzlich durch zwei Mechanismen erfolgen, dem Ubiquitin-Proteasom-System und dem Prozess der Autophagie.
- Makroautophagie
Bei der sogenannten Makroautophagie wird intrazelluläres Material (Proteinaggregate, Zellorganellen, Pathogene u.a.) von einer Membran umhüllt, die sich nachfolgend schrittweise zum Autophagosom schließt. Durch die sich anschließende Fusion mit einem Lysosom wird der Inhalt hydrolytisch abgebaut. Die Auswahl des abzubauenden Materials wird durch Rezeptormoleküle sichergestellt (selektive Makroautophagie), die einerseits mit dem Substrat, andererseits mit Proteinkomponenten der Autophagosomenmembran interagieren.
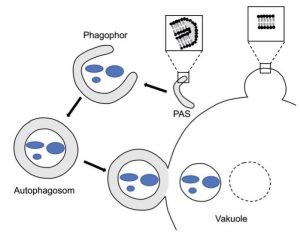
Abb. Schema der Autophagie
- Spermidin ist ein Kalorienrestriktions-Mimetikum
Spermidin ist ein Kalorienrestriktions-Mimetikum und wirkt so als ein Alterungsprotektor, welcher die Signalkaskaden des Fastens einleitet, obwohl man nicht fastet. Spermidin verlängert so die Lebensdauer. Der Hunger induziert wiederum die Spermidin-Synthese.
Eine Spermidinaufnahme (<60 µmol pro Tag) entspricht einem 5,7-jährigen jüngeren Alter.
Der Tagesbedarf von Spermidin bei einem erwachsenen, gesunden Menschen liegt bei 80 µmol/Tag bzw. 11,62 mg/Tag.
Referenzen:
Bruneck-Studie (Stegemann et al. 2014)
Kiechl S, Pechlaner R, Willeit P, et al. Higher spermidine intake is linked to lower mortality: a prospective population-based study. Am J Clin Nutr. 2018 Aug 1;108(2):371-380.
Eisenberg T, Knauer H, Madeo F et al. Induction of autophagy by spermidine promotes longevity. Nat Cell Biol. 2009 Nov;11(11):1305-14.
-
Spermidine hat eine gewichtsreduzierende Wirkung
Spermidin hat eine gewichtsreduzierende Wirkung. Spermidin verringert das weiße Fettgewebe und erhöht die Bildung von braunem Fettgewebe.
Spermidin schützt die Gehirnzellen und den Gedächtnisapparat vor oxidativem Zellstress, toxischem neuronalen Stress und nitrosativem Stress:
-
Spermidin unterdrückt den oxidativen Zellstress (Reactive Oxygen Species)
Spermidin unterdrückt den oxidativen Zellstress (Reactive Oxygen Species) und schützt so Mitochondrien und Körperzellen, inbesonders die Gehirnzellen.
Ein Spermidintransporter kontrolliert bei oxidativem Stress die Spermidin-Konzentrationen, wobei das Gen SLC18B1 einen eigenständigen vesikulären Polyamintransporter codiert und vermittelt die Induktion von Antioxidationsproteinen.
-
Spermidin stellt einen integralen Bestandteil eines neuronalen Stressantwortsystems dar
Spermidin ist ein Polyamin. Vorübergehende Veränderungen des Polyamin – Stoffwechsels, die als Polyamin–Stressantwort bezeichnet werden, sind eine häufige zelluläre Reaktion auf Stressreize, einschließlich physischer, emotionaler und hormoneller Stressfaktoren, deren Stärke mit der Stressintensität zusammenhängt.
-
Spermidinmangel fördert nitrosativen Stress und hemmt die Detoxifikation
Spermidinmangel fördert die Stickstoffmonoxid (NO)-Synthese und verursacht nitrosativen Stress.
Nitrosativer Stress ist ein Zustand, der dann entsteht, wenn Zellen zu viel Stickstoffmonoxid (NO)-Gas bilden (Stickstoffmonoxid-Gas ist ein Botenstoff der Zellen).
Große Mengen an Stickstoffmonoxid hemmen die Energiegewinnung in den Zellen, wodurch es vor allem zur Schädigung von Zellen mit hohem Energiebedarf, wie Nervenzellen, Herzmuskel, Leberzelle, Muskulatur und Zellen des Immunsystems, kommt.
Nitrosativer Stress hat weitreichende Folgen: das chronische Energiedefizit führt zu einem verfrühten Absterben der betroffenen Zellen, das Entgiftungssystem, vor allem der Glutathionstoffwechsel, wird beeinträchtigt.
Daher kann Spermidinmangel die Ursache für Erkrankungen wie dem chronischen Müdigkeitssyndrom, Fibromyalgie, posttraumatischen Stresserkrankungen und chronifizierten Infektionen sein. Typisch ist ein extremer körperlicher und seelischer Erschöpfungszustand.
Spermidin schützt vor Alzheimer-Demenz
-
Der altersabhängige Rückgang der Erinnerungsfähigkeit kann durch die Verabreichung der natürlichen Substanz Spermidin gestoppt werden.
Spermidin verbessert die Gedächtnisleistung von älteren Menschen mit erhöhtem Demenzrisiko (SmartAge-Studie- Freie Universität Berlin).
Referenz: Miranka Wirth, Claudia Schwarz, Gloria Benson, Nora Horn, Ralph Buchert, Catharina Lange, Theresa Köbe, Stefan Hetzer, Marta Maglione, Eva Michael, Stefanie Märschenz, Knut Mai, Ute Kopp, Dietmar Schmitz, Ulrike Grittner, Stephan J. Sigrist, Slaven Stekovic, Frank Madeo, Agnes Flöel. Effects of spermidine supplementation on cognition and biomarkers in older adults with subjective cognitive decline (SmartAge)—study protocol for a randomized controlled trial. Alzheimer’s Research & Therapy > Ausgabe 1/2019
-
Spermidinmangel und Alzheimer-Krankheit
Bei der Alzheimer-Krankheit besteht eine Autophagie-Dysfunktion bei Spermidinmangel, die zu eine neuritischen Dystrophie durch Beeinträchtigung der Clearance von autophagischen Vakuolen führt.
-
Toxischer Stress ist ein Risikofaktor der Alzheimer-Krankheit
Wo toxischer Stress bei lang andauernder sozialer Belastung besteht, werden auch die Mitochondrien geschädigt und eine überaktive neuronale Stress-Achse im Gehirn, HPA-Achse (hypothalamic–pituitary–adrenal- axis) genannt, führt zu einer hohen Cortisol-Konzentration.
Cortisol aktiviert die MaoA- und MaoB-Gene- Expression, die MAOB und MAOA sind für den Abbau der monoaminergen Gehirnbotenstoffe (oxidative Desaminierung) zuständig.
Die bei der oxidativen Desaminierung gebildeten zellzerstörende Substanzen z.B. Wasserstoffsuperoxid, schädigen vorab die Mitochondrien und über den Mangel an Serotonin, Dopamin und Noradrenalin, geht toxischer Stress immer auch mit depressiven Symptomen und Schädigung des Lernzentrums (Hippocampus) einher.
Das erhöhte Cortisol hemmt die Neubildung der Neurone in der subgranulären Zone des Gyrus dentatus, einem Teil der Hippocampus-Formation, wo über die Langzeit-Gedächtnis-Speicherung entschieden wird.
Spermidin ist an der synaptischen Übertragung und der synaptischen Plastizität beteiligt, die dem Lernen und dem Gedächtnis zugrunde liegen
Den Effekt des Spermidin-Mangels kann man auch bei älteren Menschen beobachten, die unter Alzheimer-Krankheit leiden. Alzheimerpatienten haben im Durchschnitt 35 % niedrigere Polyamin-Werte als gleichaltrige Menschen mit gesunden Gehirnfunktionen.
Spermidinmangel führt zu Störungen im Monoamin-Stoffwechsel: Hier kommt es zum Mangel der Nervenbotenstoffe Dopamin, Serotonin und Noradrenalin, so dass Hirnfunktionsstörungen mit Einschränkung der Kognition und Gedächtnisleistungen, der Aktivität, des Antriebes bis hin zu psychiatrischen Symptomen, wie Angst, Panik, Zwang, toxischer Stress, Burnout, Depression und Sucht die Regel sind.
Im Zentralnervensystem beeinflusst Spermidin unter anderem die Funktion von Glutamatrezeptoren vom NMDA-Typ und AMPA/Kainat-Typ, sowie einwärtsgleichrichtender Kaliumkanäle (Kir-Kanäle).
Der Spermidin-Transporter (SLC18B1) ist zur Regulierung des Polyamingehalts funktionell erforderlich. Bei fehlender Expression von SLC18B1 ist das Kurz- und Langzeitgedächtnis beeinträchtigt und die Expression von Genen verändert, die an der Langzeitpotenzierung, Plastizität, Kalziumsignalisierung und synaptischen Funktionen beteiligt sind und die Expression von Komponenten der GABA- und Glutamat-Signalisierung verändert.
Die fehlende Expression des Spermidin-Transporters führt zu einer Verringerung des Polyamingehalts in Neuronen, was zu einer verringerten GABA-Signalübertragung aufgrund einer langfristigen Verringerung der glutamatergen Signalübertragung führt.
GABA ist die Abkürzung von Gamma-Aminobuttersäure bzw. im englischen gamma-aminobutyric acid und eine natürlich vorkommende Aminosäure, die als Neurotransmitter im zentralen Nervensystem wirkt.
Spermidinmangel und Schlafverhalten
Auch auf das Schlafverhalten hat Spermidin einen Einfluss. Menschen die keine ausreichende Menge an Spermidin zu sich nehmen, haben einen verlängerten circadianen Rhythmus.
Diesen Effekt des Spermidin-Mangels kann man unter anderem auch bei älteren Menschen beobachten, die unter Alzheimer-Krankheit leiden. Alzheimerpatienten haben im Durchschnitt 35 % niedrigere Polyamin-Werte als gleichaltrige Menschen mit gesunden Gehirnfunktionen.
Durch die Zufuhr von Spermidin kann die Schlafarchitektur verbessert werden.
Spermidin hat eine kardioprotektive Wirkung
Auch auf den Herzmuskel zeigt Spermidin eine positive Wirkung.
Spermidin hat eine kardioprotektive Wirkung, wobei Spermidin die Mitochondrienfunktion stabilisiert, entzündungshemmende Eigenschaften zeigt, das Altern der Stammzellen verhindert und insgesamt die kardiovaskuläre Mortalität verringert.
Spermidin bei „Adipositas-bedingten Störungen“
Bei „Adipositas-bedingten Störungen“, wenn sie direkt mit Fettleibigkeit in Verbindung stehen, wie zum Beispiel der Hypertonie, den Herz-Kreislauf-Erkrankungen, bei hohem Cholesterinspiegel und bei Typ 2 Diabetes, wirkt Spermidin auf den Fettabbau (Lipolyse).
Die Verabreichung von Spermidin verbessert die Glukosehomöostase, die Insulinsensitivität und verringert bei Adipositas die Ansammlung von Leberfett (Steatosis hepatis).
Die Sojabohne enthält Spermidin und hoch-qualitatives Protein. Die FDA genehmigte 1999 eine gesundheitsbezogene Angabe für Sojaprotein, wonach „25 Gramm Sojaprotein pro Tag als Teil einer Diät mit niedrigem Gehalt an gesättigten Fettsäuren und Cholesterin das Risiko für Herzerkrankungen verringern können“ (FDA, 1999).
Spermidin unterstützt die Regeneration von Knorpel und Bandscheiben
Spermidin unterstützt die Funktion des Bewegungsapparats. Es zeigen sich eine schützende und regenerierende Wirkung auf Gelenkknorpel und Bandscheiben.
Spermidin ist chondroprotektiv, wobei der Effekt über Histonacetyltransferase p300 vermittelt wird, wodurch die dysregulierte Autophagie und Spermidinsynthese in gealterten und osteoarthritischen Chondrozyten verbessert werden kann.
Spermidin sorgt für die Schönheit von Haut und Haaren
Spermidin verbessert das Aussehen und die funktionellen Eigenschaften der Haut, sowie der Haare und Nägel.
Spermidin fördert das Wachstum und die Regeneration von Haut, Haaren und Nägeln, da es die Hautzellen und Hautanhangsgebilde stimuliert. Durch Spermidin kann so der Hautalterung entgegengewirkt werden.
Spermidin, zeigt eine hohe Zellaktivierung bei normalen menschlichen Haut-Fibroblasten mit einem Anti-Aging-Effekt.
Spermidin beeinflusst die Regulierung der Zellmembranfluidität und den Calciumfluss durch die Zellmembran und damit die humorale und zelluläre Immunabwehr (Lymphozytenaktivierung).
Spermidin wirkt entzündungshemmend bei akuten und chronischen Entzündungen, was auf seine antioxidativen bzw. lysosomalen Stabilisierungseigenschaften zurückzuführen ist und das kommt auch Haut und Haaren zu gute.

S-Adenosyl-L-Methionin (Ademetionin) und Spermidin sind somit grundlegende Meilensteine der Zellgesundheit.
Im Vordergrund stehen der Schutz der Mitochondrien (S-Adenosyl-L-Methionin (Ademetionin) und die Erleichterung der Zellen durch Autophagie (Spermidin).
So ergänzen sich S-Adenosyl-L-Methionin (Ademetionin) und Spermidin in idealer Weise, um die Zelle und damit den gesamten Organismus gesund zu erhalten und um ein längeres Leben zu haben.
Wenn einem diese Zusammenhänge klar sind und man auch bereits ist, rechtzeitig diese vom Alter abhängigen Substratmangelzustände durch Ademetionin- (S-Adenosyl-L-methionin)- und Spermidin-Zufuhr auszugleichen, kann die Vielzahl der sonst daraus resultierenden Krankheiten im Alter, die eine Jahrzehnte andauernde Latenzphase bis zum Vollbild der Erkrankung haben und einer rechtzeitigen Diagnose, die eine erfolgreiche Therapie ermöglicht hätte, entgangen sind, vermieden werden.
Ihr
Eduard Rappold
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
EBP® – Epigenetic Brain Protector
zum Schutz vor Gehirnzellenuntergang
enthält 400 mg Ademetionin (S-Adenosyl-L-Methionin) pro Kapsel in der biologisch aktiven (S,S) Form in präventiver Dosierung

NUGENIS Goldmedaille Iena 2015
für hervorragende Leistungen
zum Schutz vor Gehirnzellenuntergang
https://nugenis.eu/shop/
EBOP® – Epigenetic Burnout Protector
schützt bei toxischem Stress und vor Burnout
enthält 400 mg Ademetionin-(S-Adenosyl-L-Methionin) pro Kapsel in der biologisch aktiven (S,S) Form in präventiver Dosierung
https://nugenis.eu/shop/
ECP® – Epigenetic Cartilage Protector
schützt die Gelenksknorpelzellen und die Bandscheiben
enthält 400 mg Ademetionin-(S-Adenosyl-L-Methionin) pro Kapsel in der biologisch aktiven (S,S) Form in präventiver Dosierung
https://nugenis.eu/shop/

Sojapulver mit SPERMIDIN und hochwertigem SOJAPROTEIN
40 Portionen
mit
mehr als 1,7mg SPERMIDIN pro Messlöffel
SPERMIDIN-Gehalt (rot) in einer SOJABOHNE
www.spermidine-soyup.com
