
Die Mitochondrien-Qualität und -Quantität limitieren die Zellgesundheit – S-Adenosyl-L-Methionin (Ademetionin) schützt unsere Mitochondrien in zwei Teilen Teil II
Die Mitochondrien-Qualität und -Quantität limitieren die Zellgesundheit –
S-Adenosyl-L-Methionin (Ademetionin) schützt unsere Mitochondrien
in zwei Teilen
Teil II
Übersicht:
Zellgesundheit ist unser höchstes körperliches Gut. Es bedeutet, dass ein Zustand der Jugend für die Zelle und für den gesamten Organismus möglichst lange erhalten bleibt. Zelluläre Vitalität, eine gute Gesundheit und Langlebigkeit des Organismus sind damit unmittelbar verbunden.
Ein Erwachsener besteht aus 1014 oder 100 Billionen oder 100 000 000 000 000 einzelnen Zellen. In jeder dieser Zellen, mit Ausnahme der Erythrozyten, finden sich mehrere hundert Mitochondrien, in jeder Gehirnzelle sind es sogar bis zu 1000 Mitochondrien und in der sehr stoffwechselaktiven Leberzelle sind bis zu 5000 Mitochondrien enthalten.
Die Integrität der Mitochondrien bestimmt die Zellgesundheit.
„Sind unsere Mitochondrien gesund, sind auch wir gesund“.
Dem stehen entgegen: „Growing old: the most common mitochondrial disease of all?“ und der vom Alter abhängige S-Adenosyl-L-Methionin-Mangel (Ademetionin-Mangel) und die vom S-Adenosyl-L-Methionin abhängige Biosynthese von Spermidin mit konsekutivem Spermidin-Mangel.
Weil bei Spermidinmangel die Autophagie an Effizienz verliert, kommt es zu krankheitsrelevanten Ablagerungen in den Zellen, die wiederum zu Demenz, Diabetes mellitus Typ II, Tumoren und Atherosklerose führen können.
Außerdem: die vermehrte oxidative Stressbelastung (ROS- und RNS) der Zellen bei S-Adenosyl-L-Methionin- (Ademetionin)-Mangel hat ihren Ursprung im ersten Schritt des biochemischen Abbaus von Aminosäuren, der oxidativen Desaminierung, die durch überschießende Monoamin-Oxidasen (MAO)-Expression verursacht wird. Es entstehen zudem durch intermolekulare Quervernetzungen benachbarter Proteine hochmolekulare Aggregate, die nicht mehr durch das Proteasom durch Proteolyse abgebaut werden können und sich in der Zelle anreichern und dadurch deren Funktionalität beeinträchtigen.*
Die Akkumulation dieser Zellschäden begünstigt die Entstehung zahlreicher Erkrankungen, wie beispielsweise Arteriosklerose, Diabetes mellitus Typ II, Krebs, Trübungen der Augenlinse, Rheuma, Fertilitätsstörungen, Nierenleiden und unterschiedliche Hauterkrankungen durch Störung der Hautbarriere.* Auch den Alterungsprozess sollen die im Laufe des Lebens akkumulierenden oxidativen Schäden wesentlich mit bedingen.**
Es existiert eine enge Assoziation zwischen erhöhten ROS- und RNS-Spiegeln und dem Auftreten neurodegenerativer Erkrankungen wie Morbus Parkinson, Morbus Alzheimer und der amyotrophischen Lateralsklerose.* Dabei wird die besondere Vulnerabilität des Nervengewebes gegenüber oxidativem Stress zum einen durch die unzureichende Fähigkeit der Neurone zur Regeneration und zum anderen durch deren hohe Stoffwechselaktivität und die damit verbundene erhöhte endogene ROS-Produktion (oxidativer Zellstress) erklärt.***
Auch Schlaganfall und Epilepsie* können mit der erhöhten endogenen ROS-Produktion in Zusammenhang stehen. Zudem liefern Untersuchungen in den letzten Jahren auch Hinweise für eine Fehlfunktion der Mitochondrien bei psychiatrischen Erkrankungen, wie z.B. Bipolarer Störung und Depression.**
Wenn einem diese Zusammenhänge klar sind und man auch bereits ist, rechtzeitig diese vom Alter abhängigen Substratmangelzustände durch Ademetionin- (S-Adenosyl-L-methionin)- und Spermidin-Zufuhr auszugleichen, kann die Vielzahl der sonst daraus resultierenden Krankheiten, die eine Jahrzehnte andauernde Latenzphase bis zum Vollbild der Erkrankung haben, vermieden werden.
Mitochondrien und Epigenetik
Die Mitochondrienfunktion ist wichtig, um Zwischenmetabolite bereitzustellen, die zur Erzeugung von modifizierten epigenetischen Markierungen, insbesondere Histonacetylierung und Histonmethylierung sowie DNA-Methylierung, erforderlich sind.
S-Adenosyl-L-Methionin (Ademetionin), der wichtigste Methylgruppenspender an die DNA, hängt mit der Expression und der Aktivität von Proteinen wie Cystathionin-Beta-Synthase (CBS) und S-adenosylmethionine mitochondrial carrier protein (SAMC) und mit der Regulierung und ihrer cytosolischen und mitochondrialen Verfügbarkeit zusammen.
Cytosolisch synthetisiertes S-Adenosylmethionin (Ademetionin) wird mithilfe des spezifischen Mitochondrienträgers S-Adenosylmethionin (Ademetionin) -Träger (SAMC) in die Mitochondrien transportiert, um die Methylgruppe für alle mitochondrialen Methylierungsprozesse bereitzustellen.
S-Adenosyl-L-Methionin (Ademetionin) ist die Quelle für Methylgruppen, die von Histon- und DNA-Methyltransferasen (HMTs und DNMTs) im Zellkern verwendet werden. S-Adenosyl-L-Methionin (Ademetionin) wird durch die Kopplung der Folat- und Methioninzyklen im Zytosol erzeugt (Ein-Kohlenstoff-Metabolismus (C1-Metabolismus) in den Mitochondrien). S-Adenosyl-L-Methionin (Ademetionin) kann auch in die Mitochondrien gelangen, wo es von DNA-Methyltransferasen (DNMTs) zur Methylierung der mitochondriale DNA (mtDNA) verwendet wird.
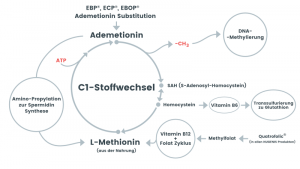
Abb. Ein-Kohlenstoff-Metabolismus (C1-Metabolismus) mit seinen drei Hauptwegen a) die Transmethylierung der DNA und Histone b) die Transsulfuration für die Glutathionbiosynthese und c) die Amino-Propylation für die Biosynthese von Polyaminen (z.B. Spermidin).
Gegenseitige Kontrolle der Mitochondrien- und Zellfunktion
Die Methylierung von nuklear DNA (nDNA) und mitochondrialer DNA (mtDNA) stellt einen Mechanismus zur gegenseitigen Kontrolle der Mitochondrien- und Zellfunktion dar.
Von der nuklearen Seite aus werden viele kernkodierte Mitochondrienproteine epigenetisch reguliert, was die Mitochondrienfunktion beeinflusst. Auch MicroRNAs (miRNAs) können die Mitochondrienfunktion regulieren. Der mitochondriale Metabolismus spielt eine wichtige Rolle bei der Modulation der Kernepigenetik durch ATP, NADH / NAD +, Citrat, Acetyl-CoA und S-Adenosyl-L- Methionin (Ademetionin). Der mitochondriale Metabolismus steuert die Methylierung der mtDNA durch Modulation der Verfügbarkeit von intramitochondrialen S-Adenosyl-L-Methionin (Ademetionin) – und Citratzyklus-Intermediaten, die die 10-11-Translokations- (TET-) Aktivität, beeinflussen können. TET-Enzyme sind eine Familie von zehn-elf Translokations (TET) -Methylcytosindioxygenasen . Sie sind maßgeblich an der DNA-Demethylierung beteiligt . TET sind Enzyme, die 5-Methylcytosine (5mCs) oxidieren, und damit das Gleichgewicht zwischen 5-Methylcytosin (5mC) und 5-Hydroxymethylcytosin (5hmC) herstellen.
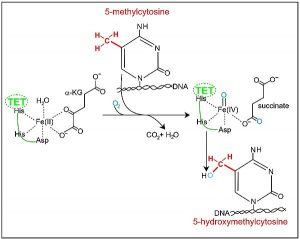
Abb. Die Umwandlung von 5-Methylcytosin zu 5-Hydroxymethylcytosin durch TET-Enzym plus a-Ketoglutarat & Fe (II)
Histonacetyltransferasen (HATs) und Histondeacetylasen (HDACs) sind Enzyme, die für die Addition bzw. Entfernung von Acetylgruppen an Histonendigungen verantwortlich sind . Ihre Aktivität erfordert spezifische metabolische Coenzyme , deren Biosynthese von den intrazellulären ATP-Spiegeln und der Mitochondrienfunktion abhängt.
Glutathion (GSH) ist ein wichtiges Antioxidans in den Zellen und in den Mitochondrien
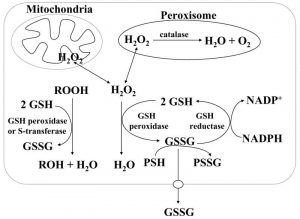 Wasserstoffperoxid, das als Ergebnis des aeroben Metabolismus erzeugt wird, kann durch Glutathion (GSH)-Peroxidase im Zytosol und in den Mitochondrien und durch Katalase im Peroxisom metabolisiert werden. Glutathiondisulfid (GSSG) das gebildet wird, wird durch GSSG-Reduktase auf Kosten von NADPH zu Glutathion (GSH) zurückreduziert, wodurch ein Redoxzyklus gebildet wird.
Wasserstoffperoxid, das als Ergebnis des aeroben Metabolismus erzeugt wird, kann durch Glutathion (GSH)-Peroxidase im Zytosol und in den Mitochondrien und durch Katalase im Peroxisom metabolisiert werden. Glutathiondisulfid (GSSG) das gebildet wird, wird durch GSSG-Reduktase auf Kosten von NADPH zu Glutathion (GSH) zurückreduziert, wodurch ein Redoxzyklus gebildet wird.
Sauerstoff (O2) ist ein elementarer Bestandteil unseres Lebens, hat aber auch pathophysiologische Eigenschaften
Im Rahmen der Zellatmung ist er wesentlich an der Bereitstellung des biochemischen Energielieferanten Adenosintriphosphat (ATP) beteiligt und dient dadurch der Aufrechterhaltung des Stoffwechsels aller aeroben Organismen.
Sauerstoff kann jedoch auch bestimmte reaktive Verbindungen eingehen, denen sowohl eine Vielzahl potentiell pathophysiologischer Eigenschaften (ROS) als auch physiologische Signalfunktionen zugeschrieben werden. Ebendies gilt auch für Verbindungen des Stickstoffs (RNS).
Obwohl das Gehirn nur 2% des Körpergewichts ausmacht, erhält es 15% des Herzzeitvolumens und macht 20% des gesamten Sauerstoffverbrauchs des Körpers aus. Dieser Energiebedarf wird hauptsächlich durch den neuronalen Energiebedarf zur Aufrechterhaltung von Ionengradienten über die Plasmamembran bestimmt, der für die Erzeugung von Aktionspotentialen entscheidend ist. Dieser intensive Energiebedarf ist kontinuierlich; selbst kurze Perioden von Sauerstoff- oder Glukosemangel führen zum neuronalen Tod.
Das Gehirn ist somit der Hauptsauerstoffverbraucher. Der oxidative Metabolismus ist sehr hoch und es fallen viele toxische O2-Metaboliten an, die entgiftet werden müssen.
Die gute und die schlechte Seite der Mitochondrien
a) Das mitochondriale oxidative Phosphorylierungssystem (OXPHOS)
Mitochondrien spielen eine Schlüsselrolle bei der Erzeugung und Regulation der zellulären Bioenergetik und produzieren den größten Teil der Adenosintriphosphatmoleküle (ATP) durch das oxidative Phosphorylierungssystem (OXPHOS).
Die Atmungskette an der inneren Mitochondrienmembran besteht aus hintereinandergeschalteten Proteinkomplexen (I-IV), entlang derer Elektronen via Redoxreaktionen von den reduzierbaren/oxidierbaren (Redox)- Molekülen der Kette weiter transportiert werden und letztlich am Komplex IV in der mitochondrialen Matrix auf den finalen Elektronenakzeptor Sauerstoff übertragen werden, wodurch dieser zu Wasser (H2O) reduziert wird. Die Elektronen werden dabei von den Reduktionsäquivalenten Nicotinamid-Adenin-Dinukleotid (NADH) und Flavin-Adenin- Dinukleotid (FADH2 ) bereitgestellt, die die Endprodukte energiegewinnender Stoffwechselwege wie der Glykolyse oder des Abbaus von Fettsäuren darstellen.
Die Reduktion von Sauerstoff zu Wasser ist also in mehrere Teilschritte aufgeteilt. Die dabei schrittweise freiwerdende Energie ermöglicht einen Protonen (H+ )- Transport an Komplex I, III und IV und erzeugt einen transmembranösen elektrochemischen H+ -Gradienten. An Komplex V, der ATP-Synthase, einer protonengetriebenen F1.F0-Turbine, folgen die Elektronen ihrem Konzentrationsgradienten und liefern dabei letztlich die Energie zur Synthese von ATP aus Adenosindiphosphat und anorganischem Phosphat.
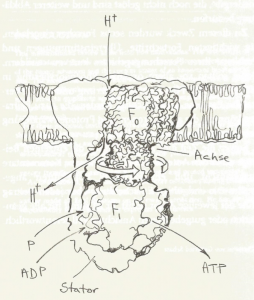
Abb. Aufbau und Wirkungsweise der protonengetriebenen F1.F0-Turbine.
Gottfried Schatz, Feuersucher, Seite 212.
Adenosintriphosphat (ATP) ist das energiereichste und effizienteste Molekül, das die Energie speichert und welches der Mensch selbst synthetisieren kann. Es ist im Zytoplasma und im Zellkernplasma jeder Zelle vorhanden. Das ATP ist im Wesentlichen in der Lage, alle physiologischen Einheiten, die Energie für ihren Betrieb fordern, zu erreichen.
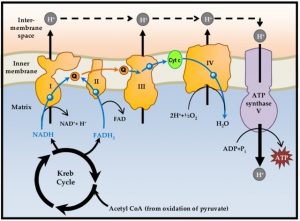
Abb. schematische Darstellung des mitochondrialen OXPHOS Systems
Neben der grundlegenden Rolle der Mitochondrien bei der Energieerzeugung (ATP) sind diese Organellen auch die Hauptproduzenten von freien Sauerstoffradikalen.
b) Mitochondrien als Hauptproduzenten von reaktiven Sauerstoff- und Stickstoffverbindungen (ROS und RNS)
Unter diesen sogenannten reaktiven Sauerstoffspezies (ROS) und reaktiven Stickstoffspezies (RNS) werden eine Gruppe reaktionsfreudiger Derivate des Sauerstoffs bzw. Stickstoffs zusammengefasst, die bis zu einem gewissen Grad unter physiologischen Bedingungen kontinuierlich im Rahmen des zellulären Metabolismus anfallen.**
Oxidativer zellulärer Stress
Oxidativer zellulärer Stress tritt auf, wenn die Sauerstoffspannung niedrig ist und die Atmungsketten übermäßig reduziert sind. Superoxid und Peroxid werden durch 1- und 2-Elektronen-Reduktion von Disauerstoff hergestellt. Die Fenton-Reaktion führt zum sehr reaktiven und schädlichen Hydroxylradikal (OH•).
Meist handelt es sich dabei um freie Radikale, also Atome oder Moleküle, die ein oder mehrere ungepaarte Elektronen besitzen und deswegen danach streben, mit anderen chemischen Verbindungen zu reagieren und Elektronen aufzunehmen, wodurch sie reduziert und letztere oxidiert werden. Andere ROS bzw. RNS verfügen über stabile Elektronenkonfigurationen und sind somit keine Radikale im engeren Sinne, weisen aber ebenfalls oxidierende Eigenschaften auf und werden genauso zu den reaktiven Verbindungen gezählt.
Die Mitochondrien gelten als wichtigste Quelle der zellulären ROS und RNS-Produktion
All diesen ROS und RNS ist gemeinsam, dass sie durch Oxidationsprozesse an zellulären Makromolekülen wie Lipiden, Proteinen oder Nukleinsäuren Zellschäden hervorrufen können und dadurch die Integrität und Funktionalität der Zelle gefährden.*
Es kommt über das Oxidative Phosphorylation-System (OXPHOS) ständig in geringerem Umfang zur Freisetzung von toxischen RONS (ROS und RNS)-Produkten.
Dazu die historische wissenschaftliche Veröffentlichung von:
Paul Boyer und Peter Mitchell et al.. Oxidative phosphorylation and photophosphorylation. Published in Annual review of biochemistry 1977.
Da nicht alle Elektronen die Atmungskette vollständig durchlaufen, entweichen durch ein sogenanntes „Elektronen-Leck“ an Komplex I und III können 1-3% der Elektronen die direkt mit Sauerstoff reagieren.*
Auch hat eine erhöhte ROS-Konzentration in den Mitochondrien als Ursache ein „Protonenleck“ in der Atmungskette, das den elektrochemischen Protonengradienten verringert. Die Atmungskette muss zur ausreichenden ATP-Produktion kompensatorisch hochreguliert werden, und mehr ROS werden gebildet.*
Ein Großteil der reaktiven Verbindungen wird an den Atmungskettenkomplexen I und III als Superoxid-Anion in die mitochondriale Matrix und an Komplex III zusätzlich in den Intermembranraum abgegeben, sodass die O2 • – – Konzentration intramitochondrial etwa fünf- bis zehnfach höher ist, als im Zytosol der Zellen.*
Die mitochondriale DNA (mtDNA) liegt frei in der Matrix der Mitochondrien und ist im Gegensatz zu der nukleären DNA weder durch einen Kern noch durch Histone geschützt. Durch die räumliche Nähe zu den an der inneren Mitochondrienmembran produzierten ROS ist die mitochondriale DNA (mtDNA) dadurch besonders anfällig für oxidative Schäden.* Da die mtDNA für einige mitochondriale Proteine, wie beispielsweise Bestandteile der Atmungskette, codiert, können sich Schäden am mitochondrialen Erbgut direkt auf die Funktionalität des Mitochondriums und dadurch auch auf die ROS-Produktion auswirken. Zudem stehen die in den Mitochondrien gebildeten ROS direkt mit dem Zytosol in Verbindung. Das Wasserstoffperoxid, das aus der Dismutation der Superoxid-Anionen entsteht, kann durch die Zellmembran diffundieren und stellt damit die direkte Kopplung von mitochondrialem und zytosolischen Redoxstatus dar.*
85% aller ROS fallen auf diese Weise als Nebenprodukt der Zellatmung in den Mitochondrien an *, auch im intermembranösen Raum der Mitochondrien durch die toxischen Endprodukte aus dem Abbau der monaminergen Neurotransmitter durch MAO B und MAOA und extramitochondrial werden reaktive Sauerstoffspezies generiert. Beispielsweise phagozytieren Zellen des Immunsystems, wie neutrophile Granulozyten und Makrophagen, Bakterien und Viren und bilden durch das Enzym NADPH-Oxidase Superoxid-Anionen, um die aufgenommenen Keime zu zersetzen und unschädlich zu machen.* In nicht-phagozytierenden Zellen produziert die NADPH-Oxidase ebenfalls reaktive Verbindungen, die dort unter anderem an der Regulation des Blutdrucks und der Proteinbiosynthese beteiligt sind.* Auch beim Purinabbau durch die Xanthinoxidase * und bei der Entgiftung toxischer Substanzen durch Cytochrom P450-Enzyme verarbeiten die Enzyme Sauerstoff, und es entstehen kontinuierlich reaktive Verbindungen.*
Übersteigt die Produktion der ROS und RNS nun jedoch die Kapazität der antioxidativen Abwehr, spricht man von oxidativem bzw. nitrosativem Stress.** Die übermäßige Oxidation durch reaktive Verbindungen kann nicht mehr ausreichend kompensiert werden, und es kommt zur Akkumulation oxidativer Zellschäden.
Eine erhöhte MAOB-Aktivität belastet das Mitochondrium unmittelbar und die Zellen mit toxischen Endprodukten aus der oxidativen Desaminierung beim Abbau von Monaminen
MAOB, die an der äußeren Mitochondrienmembran und MAOA, die an der inneren Mitochondrienmembran lokalisiert sind, sind die Orte der oxidativen Desaminierung von Monoaminen, einer Gruppe von Neurotransmittern und Neuromodulatoren. Die freiwerdenden toxischen Endprodukte führen unmittelbar zur Mitochondrienschädigung (mitochondrialer Dysfunktion und Apoptose).
Mitochondrien und nitrosativer Stress
Neben reaktiven Sauerstoffspezies gibt es auch die bereits erwähnten reaktiven Verbindungen des Stickstoffs (RNS). Die in zahlreichen Geweben vorkommende Stickstoffmonoxid-Synthase katalysiert die Reaktion der Aminosäure L-Arginin zu L-Citrullin und Stickstoffmonoxid (•NO).
•NO gilt als wichtiges Signalprotein in diversen physiologischen Prozessen, wie beispielsweise der Neurotransmission, der Hämodynamik oder der Immunabwehr. Im Rahmen entzündlicher Prozesse entsteht in Abwehrzellen aus •NO und O2 • – das radikale Peroxinitrit-Anion (ONOO- ), welches als potentes Oxidationsmittel ebenfalls der Abwehr von Pathogenen dient, während es auf zellulärer Ebene, ähnlich wie das Hydroxyl-Radikal, zu Schäden von Makromolekülen führen kann.* An Lipiden greifen Radikale die Methylengruppen mehrfach ungesättigter Fettsäuren der Membran an und setzen über die Bildung von Lipidperoxylradikalen und Lipidperoxiden eine Kettenreaktion in Gang, die letztendlich zum Verlust der Membranintegrität der Zelle führt.*
Durch Oxidationsprozesse an Nukleinsäuren kann es zu Veränderungen der Pyrimidin- und Purin-Basen und zur Schädigung des Desoxyribose-Gerüstes kommen, wodurch Doppelstrangbrüche, Mutationen und chromosomale Veränderungen hervorgerufen werden.*
Zudem verändern ROS und RNS das Methylierungsmuster der DNA als Teil des epigenetischen Codes, sodass die Regulation der Genexpression gestört wird. * Kommt es zur Akkumulation dieser DNA-Modifikationen, begünstigen sie die maligne Entartung der Zelle und dadurch die Entstehung von Krebs.*
Auch Proteine werden durch oxidativen Stress geschädigt. Vorrangig Hydroxyl-Radikale greifen die Peptidbindungen von Proteinen oxidativ an und induzieren die Fragmentierung der Polypeptidstränge.*
Die Oxidation von Aminosäureseitenketten führt unter anderem zur Bildung von Dityrosin aus zwei Tyrosin-Molekülen und zum Knüpfen von Disulfidverbindungen zwischen den Thiolgruppen zweier Cysteine.* Durch diese intramolekularen Verknüpfungen wird die Tertiärstruktur und folglich die Protein- bzw. Enzymfunktion entweder im Sinne eines loss- oder eines gain-of-function (Funktionsverlust oder Funktionsgewinn) modifiziert. Zudem entstehen durch intermolekulare Quervernetzungen benachbarter Proteine hochmolekulare Aggregate, die nicht mehr durch das Proteasom abgebaut werden können, sich in der Zelle anreichern und dadurch deren Funktionalität beeinträchtigen.*
Die Akkumulation dieser Zellschäden begünstigt die Entstehung zahlreicher Erkrankungen, wie beispielsweise Arteriosklerose, Diabetes mellitus, Krebs, Trübungen der Augenlinse, Rheuma, Fertilitätsstörungen, Nierenleiden und unterschiedliche Hauterkrankungen.*
Auch den Alterungsprozess sollen die im Laufe des Lebens akkumulierenden oxidativen Schäden wesentlich mit bedingen.* Daneben existiert eine enge Assoziation zwischen erhöhten ROS- und RNS-Spiegeln und dem Auftreten neurodegenerativer Erkrankungen wie Morbus Parkinson, Morbus Alzheimer und der amyotrophischen Lateralsklerose.*
Dabei wird die besondere Vulnerabilität des Nervengewebes gegenüber oxidativem Stress zum einen durch die unzureichende Fähigkeit der Neurone zur Regeneration und zum anderen durch deren hohe Stoffwechselaktivität und die damit verbundene erhöhte endogene ROS-Produktion erklärt.*
Das Forschungsprojekt OLDMITO von CORDIS der Europäischen Kommission für Forschung und Innovation stellt eine Ursache-Wirkungs-Beziehung zwischen den mitochondrialen Prozessen im Zusammenhang mit dem Altern von Fischen – Zebrafisch (Danio rerio), einem Fischmodell für Kurzlebigkeit und der Regenbogenforelle (Oncorhynchus mykiss) als Modell für Langlebigkeit- her. Die Zusammensetzung der Mitochondrienmembran, Lipidstoffwechsel, wobei der mitochondriale Phospholipid -Gehalt (Kardiolipin und Sphingomyelin) verändert ist, ROS-Produktion, antioxidative Aktivitäten, mitochondriale DNA-Expression wird als Wirbeltiermodell des Alterns dargestellt. Die Forschungsergebnisse sollen sich auf einen guten menschlichen Gesundheitszustand auswirken.**
Zytoplasmatisches Kalzium im Mitochondrium
Weitere wichtige Mitochondrienfunktionen sind die Regulation des intrazellulären Calcium- und Redox-Signals. Mitochondrien haben die Fähigkeit Ca 2+ aus dem Zytoplasma zu entfernen und es in ihrer Matrix anzureichern. Sie sind an vielen Ca 2+ -vermittelten Signalprozessen beteiligt und regulieren schnelle Änderungen der intrazellulären Calciumkonzentrationen. Mitochondriale Calcium-Uniporter und -Antiporter sind charakterisiert.
Ca 2+ Spiegel sind an der Regulierung der ATP-Produktion beteiligt. Zunächst wurde angenommen, dass der Hauptregulator der ATP-Produktion die relative Konzentration von energetisch hohen Phosphaten ist. Heutzutage wird angenommen, dass die ATP-Produktion durch verschiedene Mechanismen reguliert wird: Einer von ihnen ist der intramitochondriale Ca 2+ -Spiegel. Ca 2+reguliert die Aktivität von Dehydrogenasen: Glycerophosphatdehydrogenase, Pyruvatdehydrogenase, Isocitratdehydrogenase und α-Ketoglutaratdehydrogenase. Über diese Enzyme führen Ca 2+-Niveaus zu einer erhöhten ATP-Produktion, Produktion von Glykogen und Glucoseoxidation.*
Die Bedeutung von Mitochondrien bei Neuroplastizität, Synaptogenese und Axogenese
Mitochondrien sind dynamische Organellen; Ihre Funktion wird durch Spaltung, Fusion und Bewegung innerhalb der Axone und Dendriten moduliert. Ihre Struktur, Funktionen und Eigenschaften unterscheiden sich in Axonen und Dendriten. Transport und die Positionierung von Mitochondrien sind für die neuronale Homöostase von entscheidender Bedeutung, und die Mitochondrienbewegung ist Teil der Regulation durch intrazelluläre Signale.
Mitochondriale Verteilung und Aktivität sind Schlüsselfaktoren in der neuronalen Morphogenese – Synaptogenese, entwicklungsbedingter und synaptischer Plastizität und Axogenese. Während der Entwicklung vermehren sich neuronale Stammzellen und differenzieren sich zu Neuronen. Anschließend bilden Axone und Dendriten Synapsen. Aufgrund der ATP-Produktion und der Bedeutung von Mitochondrien für die Homöostase synaptischer Ionen und Phosphorylierungsreaktionen sammeln sich Mitochondrien an Orten an, an denen ATP und Ca 2+ verbraucht werden.
Als dynamische Strukturen bilden Mitochondrien ein sich ständig wandelndes Netzwerk, das sich im Minutentakt verändert. Laufend teilen sich die Mitochondrien und fusionieren anschließend wieder miteinander. Die zufälligen Bewegungen der Mitochondrien sind entlang der Fasern des Zellskeletts, den Mikrotubuli. Dabei ist ihre räumliche Struktur dafür verantwortlich, wie effektiv sie Energie liefern können: Faserige, miteinander verbundene Netzstrukturen sind dazu in der Lage viel Energie zu produzieren, kleinere Fragmente sind dagegen weniger effektiv.
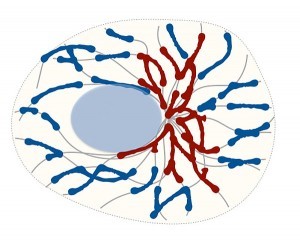
Abb. Das Zellskelett (graue Linien) beeinflusst die Fusion der Mitochondrien. Es teilt sie in faserige Netzstrukturen (rot) und kleinere Fragmente (blau) und formt so deren Netzwerk.
In Zellen verschmelzen Mitochondrien routinemäßig, teilen sich (spalten), verzweigen sich und ändern ihre Größe auf dynamische Weise. Dieser als mitochondriale Netzwerkdynamik bezeichnete Prozess ermöglicht eine ordnungsgemäße mitochondriale Funktion, einschließlich Vererbung und Aufrechterhaltung der mtDNA, Regulierung der Stoffwechselenergie, mitochondrialer Aufrechterhaltung einer gesunden mitochondrialen Population. Mutationen im Zusammenhang mit diesem Prozess wurden zuvor mit neurodegenerativen Erkrankungen wie Parkinson- und Huntington-Erkrankungen in Verbindung gebracht. Aber auch bei der Schizophrenie wurde im Zusammenhang mit Defiziten des mitochondrialen oxidativen Phosphorylierungssystems (OXPHOS) über Beeinträchtigungen der mitochondrialen Netzwerkdynamik berichtet.
Die Aminosäure Glutamat stellt innerhalb des ZNS den wichtigsten exzitatorischen Neurotransmitter dar. Sie ist an wichtigen Aufgaben wie Synaptogenese, Dendritenwachstum und Gedächtnisbildung beteiligt, sowie auch an neuronaler Proliferation und Apoptose. Liegt Glutamat jedoch in pathologisch erhöhten Konzentrationen vor, kann innerhalb weniger Millisekunden Glutamat ein rapider Anstieg der ROS-Konzentration (freie Radikale) im Sinne von Exzitotoxizität oxidativen Stress auslösen.
Unterschiede zwischen mitochondrialer und nuklearer DNA
Die einzigartige Eigenschaft der Mitochondrien ist der Besitz ihrer DNA (mtDNA), die mütterlicherseits vererbt wird.
Es gibt verschiedene Unterschiede zwischen mitochondrialer und nuklearer DNA:
Mitochondriale DNA (mtDNA) ist sehr kompakt und Introns sind selten. Es gibt weder Reparaturmechanismen noch Histone.
Im Zellkern dagegen gibt es zahlreiche Mechanismen zur Vorbeugung und Reparatur, die die DNA vor Schäden schützen. Zusätzlich ist die nukleare DNA (nDNA) durch Histone geschützt.
Die Gefährdungslage der Mitochondrien kann so erklärt werden. Es wird vermutet, dass mtDNA aufgrund der Nähe der inneren Mitochondrienmembran mit der oxidativen Phosphorylation und dem intermembranösen Raum, wo MAO B für die oxidative Desaminierung der Monamine verantwortlich ist, empfindlicher auf oxidative Veränderungen reagiert. Superoxid-Anionenradikal, Hydroxylradikal und Produkte der Lipidperoxidation können mtDNA-Mutationen und mtDNA-Schäden verursachen.
Diese Faktoren tragen zur Anhäufung von mtDNA-Mutationen und mtDNA-Schäden bei, die ungefähr eine zehnmal größere Rate als bei der nuklearen DNA haben.
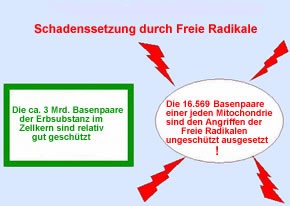
Abb. Mitochondrien sind besonders empfindlich auf oxidativen Zellstress
Mitochondriale Dysfunktion
Mitochondriale Dysfunktion ist ein sehr frühes Ereignis bei vielen neurodegenerativen Erkrankungen, wie Huntington (HD = Huntington’s disease), Parkinson (PD = Parkinson’s disease), Alzheimer Demenz (AD = Alzheimer’s disease), Amyotrophe Lateralsklerose (ALS = amyotrophic lateral sclerosis), Schlaganfall, und Epilepsie.* Zudem liefern Untersuchungen in den letzten Jahren auch Hinweise für eine Fehlfunktion der Mitochondrien bei psychiatrischen Erkrankungen, wie z.B. Bipolarer Störung und Depression.***
Mitochondriale Dysfunktion bei Alzheimer-Krankheit
Neurodegenerative Erkrankungen, wie die Alzheimer-Krankheit, sind gekennzeichnet durch selektive Dysfunktion und fortschreitendem Verlust von Synapsen und Neuronen, die mit pathologisch veränderten Proteinen assoziiert sind, die sich hauptsächlich im menschlichen Gehirn und Rückenmark ablagern.**
Bei Morbus Alzheimer stützt eine Vielzahl von Befunden die Annahme einer mitochondrialen Funktionsstörung in der Pathogenese der Alzheimer-Erkrankung. Proteine, die mit der Erkrankung assoziiert sind (amyloid precursor protein = APP und β-Amyloid-Peptide = Aβ) haben einen direkten Einfluss auf die Mitochondrien und verursachen eine mitochondriale Funktionsstörung.* APP (amyloid precursor protein) besitzt eine mitochondriale Erkennungssequenz und kann dadurch über die mitochondriale Proteinimport-Maschinerie in die Mitochondrien aufgenommen werden. Durch die Überexpression von APP wird der essentielle Importmechanismus überlastet und dies führt zu einer mitochondrialen Funktionsstörung und einem gestörten Energiestoffwechsel.* Aβ (β-Amyloid-Peptide) kann ebenfalls in die Mitochondrien gelangen und durch die Interaktion mit verschiedenen Proteinen und Atmungskettenkomplexen, Aß (β-Amyloid-Peptide) inhibiert die Aktivität der Cytochrom C Oxidase (Komplex IV) und verstärkt somit die ROS-Produktion* und trägt zur Störung der Energieproduktion und zur Entstehung von ROS bei.*
Mitochondriale Dysfunktion, oxidativer Stress und Autophagie hängen eng mit der AD-Pathogenese zusammen.*
Mitochondriale Anomalien, die mit erhöhtem oxidativem Stress einhergehen, spielen seit langem eine wichtige Rolle bei der Degeneration und dem Tod von Zellen, die bei der Alzheimer-Krankheit auftreten. Tatsächlich leiden Mitochondrien während der Entstehung der Alzheimer-Krankheit unter tiefgreifenden Veränderungen, die zu einer verringerten Bildung von Adenosintriphosphat (ATP) und einer erhöhten Produktion von reaktiven Sauerstoffspezies (ROS) führen. Mitochondrien verlieren auch an Kalzium (Ca 2+) Pufferkapazität, die in einer Kaskade Schäden innerhalb der Zelle auslösen kann.
Beeinträchtigte Mitochondrien setzen bei Induktion der Apoptose auch mehrere proapoptotische Faktoren frei. Diese Faktoren lösen entweder direkt die Apoptose aus, indem sie sich mit cytosolischen Faktoren verbinden, um das Apoptosom zu bilden. Schließlich translozieren einige mitochondriale, proapoptotische Proteine in den Kern, um eine Desoxyribonukleinsäure (DNA) -Fragmentierung zu induzieren. Insgesamt tragen diese mitochondrialen Veränderungen zur Zelldegeneration und zum Tod bei.*
Infolge der unzureichenden Verdauung oxidativ geschädigter Makromoleküle und Organellen durch Autophagie, akkumulieren Neuronen nach und nach Lipofuscin, das die neuronale Dysfunktion verschlimmern können.
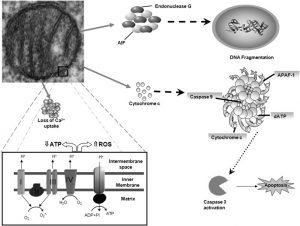
Abb. Mitochondriale Dysfunktion bei Alzheimer.
Mitochondriale Dysfunktion ist ein frühes Ereignis bei der Alzheimer-Krankheit
Mitochondrien spielen in einzigartiger Weise eine entscheidende Rolle für das Überleben oder den Tod neuronaler Zellen, da sie sowohl den Energiestoffwechsel als auch den Zelltod regulieren. In der Tat gibt es starke Anzeichen dafür, dass oxidativer Stress vor dem Auftreten der Symptome bei Alzheimer-Krankheit auftritt und dass oxidative Schäden nicht nur in den anfälligen Regionen des Gehirns, die von der Krankheit betroffen sind, sondern auch im Riechhirn und peripheren Leukozyten auftreten. Eine olfaktorische Dysfunktion (schwerer Anosmie) bei Alzheimer-Krankheit (AD) und einer leichten kognitiven Beeinträchtigung, die das Fortschreiten der Demenz ankündigt, hängt mit der Ablagerung von pathologischen Proteinen, wie α-Synuclein, hyperphosphoryliertem Tau-Protein und Neurofilament-Protein in diesen Bereichen zusammen.****
Es konnte gezeigt werden, dass oxidative Schäden vor der Bildung von Aβ-Plaques auftreten:
Swerdlow und Khan haben vorgeschlagen, die Mitochondrien – Kaskade Hypothese für die LOAD (late onset AD) als Ursache zu erklären. Kurz gesagt, diese Hypothese besagt, dass bei der sporadischen Alzheimer-Krankheit (AD) die mitochondriale Dysfunktion das Hauptereignis ist, das die Ablagerung von Aβ, die synaptische Degeneration und die Bildung von NFTs verursacht.**
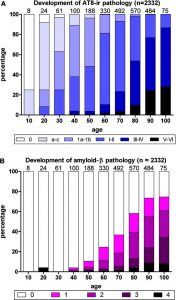
Abb. Stadien des pathologischen Prozesses bei Alzheimer: Alterskategorien von 1 bis 100 Jahren.*
Mitochondriale Dysfunktion und Alter
Mitochondrien stehen unter dem Generalverdacht, Verursacher von Alterungsprozessen zu sein. Stets führt ein Teil (1–5 Prozent) der in der Atmungskette transportierten Elektronen zur Bildung von Sauerstoffradikalen (ROS, reactive oxygen species). ROS-Produkte oxidieren Lipide, Proteine und Nukleinbasen. Dadurch werden insbesondere die Mitochondrien selbst geschädigt, die dann ihrerseits mehr ROS bilden, so entsteht eine positive Rückkopplung, ein Circulus vitiosus, mit negativer Wirkung auf die Zellen des Organismus.***
Die wissenschaftliche Evidenz, dass Altern mit Schädigung und Funktionsstörung der Mitochondrien einhergeht, ist überwältigend. Schon 1992 konnte in mehreren humanen postmitotischen Geweben (u. a. Gehirn und Muskel) gezeigt werden, dass es im Rahmen des Alterns zur Akkumulation von mtDNA-Mutationen und -Deletionen kommt*, was zur Frage führte: „Growing old: the most common mitochondrial disease of all?“ (Harding 1992).
Diese mtDNA-Schädigung führt zu einer reduzierten Lebensspanne sowie zu vorzeitig einsetzendem Altern unterschiedlicher Organsysteme. Dieser Alterungs-Phänotyp ist verbunden mit einer kontinuierlichen Abnahme der Atmungskettenfunktion und einer verminderten ATP-Produktion.*
Die mitochondriale Theorie von Altern und Neurodegeneration (Harman 1972) postuliert einen molekularen Teufelskreis, in dem sich oxidativer Stress und Schäden an mitochondrialen Proteinen und mitochondrialer DNA (mtDNA) gegenseitig verstärken.
Mitochondriale Dysfunktion durch Umfeld- und Lebensstil- abhängigen Ademetioninmangel
Swerdlow und Khan haben vorgeschlagen, die Mitochondrien – Kaskade Hypothese für die LOAD (late onset AD) für ursächlich zu erklären. Kurz gesagt, diese Hypothese besagt, dass bei der sporadischen Alzheimer-Krankheit die mitochondriale Dysfunktion das Hauptereignis ist, das die Ablagerung von β-Amyloid-Peptide (Aβ), die synaptische Degeneration und die Bildung von Neurofibrillary tangles (NFTs) verursacht.**
Das Exposom als „physikalischer Rezeptor“ für Veränderungen am Epigenom bei Belastungen und Einflüsse aus dem Umfeld
Unser Exposom ist die Summe einer großen Anzahl von Variablen und wirkt als „physikalischer Rezeptor“ am Epigenom für Belastungen und Einflüsse aus dem Umfeld, wie
- die Qualität und Quantität der Ernährung (Ernährung mit Optimierung unseres Methylkapitals nach dem Vorbild der Kreta-Diät, Phytonährstoffe, bis zur kalorienreduzierten „epigenetischen Diät“, Spermidin-Zufuhr als Kalorienrestriktions-Mimetikum),
- körperliche Aktivität, die konkrete positive Auswirkungen auf das Epigenom hat, unser
- soziales Milieu, wie Freundschaften und familiäre Beziehungen, und die Art und Weise wie wir aufwachsen, begleitet von mütterlicher Fürsorge oder
- Kindheitstraumata, wie sie verursacht werden durch ein unstrukturiertes Umfeld, prekäre und unstabile Bedingungen und kindlicher Not durch Gewalttätigkeiten,
- Einsamkeit,
- Trauer,
- toxischer Stress, Burnout und Depressionen,
- Störungen des Tagesrhythmus (Jet Lag, Schichtarbeit, Schlafentzug),
- persönlicher Lebensstil, wie zum Beispiel Meditation,
- Abusus von Schadstoffen: Tabak, Alkohol, Drogen,
- Umweltchemikalien (Pestizide),
- Medikamente wie bei PPI-Langzeiteinnahme und einer Langzeitcortisoltherapie,
- Medikamentenrückstände,
- Lebensmittelkontaminante, Schimmelpilzgifte, Fremdöstrogene (z.B. Bisphenol A oder Parabene) sowie Pflanzenhormone,
- hässliche, lärmbelastete Nachbarschaft, Mangel an Grünflächen,
- alle haben Auswirkungen, ob sie als „Stress“ oder nicht wahrgenommen werden.
- Selbst Erfahrungen und Emotionen können ihrerseits in einem epigenetischen Prozess auf die Gene modulierend wirken.
Eine überaktive HPA-Achse fördert die Monoamin-oxidase- Expression und verursacht toxischen Stress
Toxischer Stress durch eine überaktive Stress-Achse im Gehirn, HPA-Achse (hypothalamic–pituitary–adrenal- axis) genannt, spielt ebenfalls eine bedeutende Rolle bei der Generierung von mitochondrieler Dysfunktion. Cortisol fördert die MAOB-Expression.
Wo toxischer neuronaler Stress aktiv ist, geht es immer auch um depressive Symptome, Burnout und Schädigung des Lernzentrums im Gehirn, dem Hippocampus. Chronischer Stress gilt entsprechend auch als ein wesentlicher Risikofaktor für die Entwicklung der Alzheimerkrankheit, könnte aber auch eine Folge der Erkrankung sein.*
Rett-Syndrom
Das Rett-Syndrom hat einen stadienhaften Krankheitsverlauf und gilt als eine neuronale Entwicklungsstörung, bei der krankheitsauslösend dysfunktionale Mitochondrien und vermehrter oxidativer Stress vermutet werden.
Bei dem Rett-Syndrom, wurden Vakuolen und Schrumpfungen der Mitochondrien an Hirnpräparaten von Rett-Patientinnen beschrieben.**
Apoptose „progammierter neuronaler Tod“
Die biochemische Aktivierung der Apoptose erfolgt über zwei Hauptwege: den intrinsischen und den extrinsischen apoptotischen Weg.
Der extrinsische Weg beinhaltet Todesrezeptoren (z. B. Fas) und der intrinsische Weg der Apoptose beinhaltet Mitochondrien.
Die Mitochondrien entwickelten dazu ein Selbstzerstörungssystem, die mitochondriale Permeabilitätsübergangspore (mtPTP).
Das mtPTP wird aktiviert, wenn die biochemische Gesundheit der Mitochondrien und Zellen abnimmt, insbesondere wenn die mitochondriale Energieproduktion abnimmt, die ROS-Erzeugung zunimmt und übermäßiges Ca ++ in das Cytosol freigesetzt und vom Mitochondrium aufgenommen wird. Wenn das mtPTP aktiviert ist, öffnet es einen Kanal in der mitochondrialen Innenmembran und initiiert den programmierten Zelltod (Apoptose) .**
Zahlreiche Untersuchungen haben ergeben, dass das Schicksal der Zelle nach einer Beleidigung vom Ausmaß der mPTP -Aktivierung abhängt. Wenn die mPTP nur in geringem Maße auftritt, kann sich die Zelle erholen, während sie, wenn sie häufiger auftritt, Apoptose erleidet. Wenn es in einem noch größeren Ausmaß auftritt, ist es wahrscheinlich, dass die Zelle einen nekrotischen Zelltod erleidet.
Die Mitochondrien befinden sich so an einer strategischen Position in der Hierarchie der Zellorganellen, um das gesunde Leben der Zelle fortzusetzen, indem sie die Zellgesundheit fördern oder beenden. Falls es erforderlich ist, treffen sie eine schnelle Entscheidung, um den programmierten Zelltod einzuleiten.
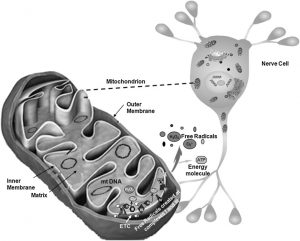
Abb. Doppelte Rolle der Mitochondrien. Neben der grundlegenden Rolle der Mitochondrien bei der Energieerzeugung (ATP) sind diese Organellen auch die Hauptproduzenten von freien Sauerstoffradikalen. Wenn die Abwehrmechanismen geschwächt werden, lösen diese reaktiven Spezies eine Kaskade schädlicher Ereignisse in der Zelle aus.
ETC, Elektronentransportkette; H 2 O 2 , Wasserstoffperoxid; mtDNA, mitochondriale DNA; O 2 – , Superoxidanionenradikal; e – Elektronen; O 2 , molekularer Sauerstoff.*
, Superoxidanionenradikal; e – Elektronen; O 2 , molekularer Sauerstoff.*
Der Weg zur Zellgesundheit
Zellgesundheit ist unser höchstes körperliches Gut. Es bedeutet, dass ein Zustand der Jugend für die Zelle und für den gesamten Organismus möglichst lange erhalten bleibt. Zelluläre Vitalität, eine gute Gesundheit und Langlebigkeit des Organismus sind damit unmittelbar verbunden.
- Eine bedarfsdeckende und altersabhängige S-Adenosyl-L-Methionin- (Ademetionin)-Substitution für die Methylierung der DNA und Histone führt zur Reduktion der zytotoxischen MAOA und MAOB-Überexpression
- Eine bedarfsdeckende und altersabhängige S-Adenosyl-L-Methionin- (Ademetionin)-Substitution sichert die Spermidin-Biosynthese durch Aminopropylation im C1-Zyklus.
- S-Adenosyl-L-Methionin- (Ademetionin)-Substitution schützt die Mitochondrien indem weniger ROS -Abbauprodukte aus der oxidativen Desaminierung von Dopamin und anderer monaminerger Neurotransmitter zu Zytotoxizität und Apoptoseinduktion in den Mitochondrien führen.
- Eine bedarfsdeckende und altersabhängige S-Adenosyl-L-Methionin- (Ademetionin)-Substitution sichert die Glutathion-Biosynthese durch Transsulfuration im C1-Zyklus. Glutathion ist das potenteste Antioxidans der Zelle.
- Eine bedarfsdeckende und altersabhängige S-Adenosyl-L-Methionin- (Ademetionin)-Substitution schützt die Zelle vor ER-Stress (ER=Endoplasmatisches Retikulum) und ermöglicht eine reguläre Proteinsynthese.
- Eine bedarfsdeckende und altersabhängige S-Adenosyl-L-Methionin- (Ademetionin)-Substitution induziert die Spermidin-Biosynthese, ermöglicht eine reguläre Membranogenese und fördert die Autophagie, die mit Autophagosomen nach Fusion mit Lysosomen, fehlgefaltete Proteine, Viren und Bakterien aus der Zelle ausschleust, und den zellulären Substrattransport in Vakuolen ermöglicht.
- Zellgesundheit repräsentiert die jugendliche Unschuld der Zelle. Zellgesundheit verzögert die Zellalterung als pathophysiologische Folge, die zu Schäden an den Zellbestandteilen führt, die Krankheiten verursachen.
- Präventive Substitution von S-Adenosyl-L-Methionin- (Ademetionin) und von Spermidin sichert die Zellgesundheit.
Wenn einem diese Zusammenhänge klar sind und man auch bereits ist, rechtzeitig diese vom Alter abhängigen Substratmangelzustände aus zu gleichen, dann kann die Vielzahl der sonst daraus resultierenden Krankheiten, die eine Jahrzehnte andauernde Latenzphase bis zum Vollbild der Erkrankung im Alter haben, vermieden werden.
Mit * bezeichnete Stellen verweisen auf Literaturangaben.
Ihr
Dr. med. Eduard Rappold, MSc
Ende des II. Teils
zum I. Teil: https://epigenetik.at/die-mitochondrie…chondrien-teil-i/
Für Erni Ullram, die ich heute auf ihrem letzten Weg begleiten werde.
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
EBP® – Epigenetic Brain Protector
enthält 400 mg S-Adenosyl-L-Methionin- (Ademetionin) pro Kapsel in präventiver Dosierung

NUGENIS Goldmedaille Iena 2015
für hervorragende Leistungen
zum Schutz vor Gehirnzellenuntergang
EBOP® – Epigenetic Burnout Protector
enthält 400 mg S-Adenosyl-L-Methionin- (Ademetionin) pro Kapsel in präventiver Dosierung
ECP® – Epigenetic Cartilage Protector
enthält 400 mg S-Adenosyl-L-Methionin- (Ademetionin) pro Kapsel in präventiver Dosierung
Sojapulver mit SPERMIDIN und SOJAPROTEIN
www.spermidine-soyup.com
Sichert die reguläre Proteinsynthese,Spermidin induziert die Autophagie und
ist ein Kalorienrestriktionsmimetikum

40 Portionen
mit
mehr als 1,7mg SPERMIDIN pro Messlöffel
