Angewandte Epigenetik: EBP® – Epigenetic Brain Protector
EBP® – Epigenetic Brain Protector

Ein Nahrungsergänzungsmittel der Angewandten Epigenetik mit dem S-Enantiomer, die ausschließlich biologisch aktive Form von S-Adenosyl-L-Methionin als gecoatetes Granulat, mit den für seine Biosynthese wichtigen Vitaminen und einem Spurenelement in präventiver Dosierung in magensaftresistenten Kapseln.
Der EBP® – Epigenetic Brain Protector schützt Gehirnzellen vor dem Zelluntergang.
Ademetionin (S-Adenosylmethionin, Abkürzung: SAM) ist nach ATP (Adenosintriphosphat) dem zellulären Energieträger, das wichtigste Molekül, das an über 100 metabolischen Prozessen mitwirkt und die Zelle schützt.
Ademetionin (S-Adenosylmethionin, Abkürzung: SAM) ist der solitäre Methylgruppenspender für den DNA-Code, dem Bauplan der Erbsubstanz. Die Methionin-Adenosyltransferase (MAT) ist für die Synthese von S-Adenosylmethionin aus Methionin und ATP verantwortlich und sorgt für die Aufrechterhaltungsmethylierung im somatischen Gewebe und so für die normale Entwicklung eines Organismus und ist so es für das Überleben einer Zelle unverzichtbar.
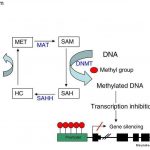
Abb. DNA-Methyltransferase (DNMT) = Methionin-Adenosyltransferase (MAT)
S-Adenosylmethionin ist unentbehrlich für die drei Hauptstoffwechselwege:
# Für die Transmethylierung, wo Methylgruppen (-CH3) von S-Adenosylmethionin stammend, sich an die 5′-Position am Cytosinring der DNA-Erbinformation reversibel anheften und Gene vorübergehend abschalten können. Der DNA-Code bleibt dabei unverändert.
# Für die Transsulfurierung zur Synthese von Glutathion, dem potentesten Antioxidans zum Schutz vor oxidativer Zellschädigung und die
# Biosynthese von Spermidin und Spermin durch Aminopropylierung.
So gilt heute das S-Adenosylmethionin als Schlüsselregulator für den Zellstoffwechsel, die Zellproliferation, Zelldifferenzierung, Apoptose und Zelltod.
Eine weitere entscheidende Rolle hat S-Adenosylmethionin beim Schutz unserer Mitochondrien.
Methylierung des Genortes der MAO verhindert die Monoaminoaxidase-Überexpression mit ROS-Belastung der Mitochondrien.
„Geht es unseren Mitochondrien gut, dann sind auch wir gesund“.
Was sich ein jeder wünscht: Gesundheit und Wohlergehen, dafür sorgen unsere Mitochondrien.
Mitochondrien produzieren über die Atmungskette, die an der inneren Mitochondrienmembran lokalisiert ist, ATP (Adenosintriphosphat). Die Tagesproduktion von ATP entspricht unserem Körpergewicht!
Mitochondrien sind eine bedeutende Energiequelle für die Stoffwechselprozesse, so auch bei der Biosynthese des S-Adenosylmethionin, dem „aktiven Methionin“ (Cantoni,1977) d.h. dem mit ATP verbundenen Methionin.
Das Gute – dieser Satz steht fest –
ist stets das Böse, was man läßt. (Wilhelm Busch)
Mitochondrien tragen an der äußeren Mitochondrienmembran die Monoaminooxidase B (MAOB), die über oxidative Desaminierung von Neurotransmittern, z.B. Dopamin, Serotonin und Noradrenalin mit dem hochreaktiven und aggressiven Hydroxyl-Radikal •OH (Boveris und Chance 1973; Milton und Sweeney 2012), das mit nahezu allen umgebenden Makromolekülen, wie Lipide, Proteine und Desoxyribonukleinsäuren ( DNA) reagiert und diese Zellstruktuten oxidiert und so zu vielfältigen Zellschäden führt (Valko et al. 2007).
Neurone in fortgeschrittenen Alzheimer Demenz (AD)-Fällen weisen eine signifikante Beschleunigung der DNA-Methylierungsalterung um 3,67 ± 1,61 Jahre durch DNA-Hypomethylierung auf.
Die CpH-Methylierung (DNA methylation at non-CpG sites) ist genauso wirksam bei der Unterdrückung der Gentranskription wie die CpG-Methylierung und ist an aktiven Enhancern und Promotoren angereichert, was bedeutet, dass der Verlust der CpH-Methylierung an Enhancern bei AD typischerweise eine Aktivierung von Zielgenen darstellt.
Nagamatsu ST, Rompala G, Hurd YL, Núñez-Rios DL, Montalvo-Ortiz JL; Traumatic Stress Brain Research Group. CpH methylome analysis in human cortical neurons identifies novel gene pathways and drug targets for opioid use disorder. Front Psychiatry. 2023 Jan 19;13:1078894. doi: 10.3389/fpsyt.2022.1078894. PMID: 36745154; PMCID: PMC9892724.
Enhancer, die für die Überexpression von Presenilin1 und BACE1, in AD-Neuronen verantwortlich sind, stellen eine molekulare Verbindung zwischen einer übermäßigen γ-Sekretase-Produktion und Aβ-Produktion und dem Fortschreiten der Amyloidpathologie und der neurofibrillären Taupathologie her.
AD-Neurone weisen einen abnormalen Zellzyklus-Wiedereintritt auf und eine Überstimulation der apoptotischen und entzündlichen Signalwegen, was zum neuronalen Tod und zu kognitiven AD-Symptomen führt.
Im Alter von 55 bis >79 Jahren sind die frontalen, präfrontalen und parietalen altersbedingten Rückgänge der kortikalen Gewebedichten am größten (RAZ N. 2000).
Um eine neue Strategie zur Verlangsamung der kognitiven Beeinträchtigung in der präklinischen Phase zu entwickeln, die häufig mit Stimmungsänderungen verbunden ist, denkt man daran jene Mechanismen aufzuklären, die die Monoaminfreisetzung modulieren (Maria Grazia Morganese 2019).
Ademetionin vermeidet die Untermethylierung des DNA-Codes der Erbsubstanz. Untermethylierung am Ort des MAOB-Genortes hat eine vermehrte MAOB-Produktion zur Folge. MAOB ist im Alter, durch den altersbedingten Ademetionin-Mangel, auf das 3 – 4-fache erhöht, beschleunigt den Alterungsprozess und mindert die Lebensdauer ganz entscheidend.
Die Epigenetik zeigt uns, dass das Epigenom als „physikalischer Rezeptor“ wirkt. Belastungen und Einflüsse aus dem Umfeld, die Qualität und Quantität der Ernährung, das Rauchen, Alkoholabusus, der Mangel an körperlicher Bewegung, Einsamkeit, Trauer, Störungen des Tagesrhythmus (Jet Lag, Schichtarbeit, Schlafentzug), sogar Mangel an Grünflächen, sie alle haben Auswirkungen, ob sie als „Stress“ oder nicht wahrgenommen werden. Selbst Erfahrungen und Emotionen können ihrerseits in einem epigenetischen Prozess auf die Gene modulierend wirken und eine vermehrte MAOB-Expression verursacht die Störung und Zerstörung von Mitochondrien und Zellen .

Abb. Gesundheitsschädliches Verhalten durch Stress moduliert mittels epigenetischer Mechanismen unsere Gene. Stressbedingtes Cortisol induziert die MAOB-Expression.
Ademetionin fördert die DNA-Methylierung. Der epigenetische Weg dazu ist das sogenannte „gene silencing“, die Stilllegung (Inaktivität) der Genexpression von Monoaminooxidase B (MaoB) am Genort der DNA.
Die etwa ab dem 35. Lebensjahr zunehmend verminderte Ademetionin-Biosynthese führt über MAOB Überproduktion zu mitochondrialer Dysfunktion. Die Zahl der Mitochondrien pro Zelle und die ATP (Energie)-Produktion nehmen ab, die Limitation dieses Prozesses ist der Zelltod.
Das ist auch der Ursprung vieler Krankheiten, die im Altern mit einem konstitutionellen Ademetionin-Mangel verbunden sind.
Bei vielen neurodegenerativen Erkrankungen, wie Huntington (HD = Huntington’s disease), Parkinson (PD = Parkinson’s disease), Alzheimer Demenz (AD = Alzheimer’s disease), Amyotrophe Lateralsklerose (ALS = amyotrophic lateral sclerosis), Schlaganfall, und Epilepsie (Lin et al., 2006). Zudem liefern Untersuchungen in den letzten Jahren auch Hinweise für eine Fehlfunktion der Mitochondrien bei psychiatrischen Erkrankungen, wie z.B. Bipolarer Störung und Depression (Kato, 2006; Shelton, 2007) und metabolische Erkrankungen, wie Diabetes mellitus (Schultz et al., 2010).
Da die mitochondriale Dysfunktion ein sehr frühes Ereignis ist, kommt der individuellen Gesundheitsvorsorge durch Prävention des altersabhängigen Ademetionin-Mangels und seiner Folgen eine persönliche und sozialmedizinische entscheidende Bedeutung zu.
Der EBP® – Epigenetic Brain Protector enthält die aktive Form des S-Adenosylmethionins und schützt die Gehirnzellen und die endotheliale Blut-Hirn-Schranke
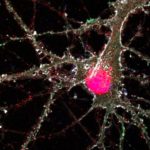
Abb. Immunzytochemie in Neuronen zur Aufklärung der MAO-B-Position in Bezug auf die Synapse. (Sophia Schedin-Weiss 2017)
Die Monoaminooxidase B (MAOB) findet sich im Gehirn in der äußeren Mitochondrienmembran von dopaminergen Nervenzellen des Cingulums, einem Teil des limbischen Systems, das mit Assoziationsbahnen das Frontalhirn mit dem Hippocampus verbindet. Zugleich findet sich MAOB in den protoplasmatischen Astrozyten. Das sind Neurogliazellen, die Hirnkapillaren und Nervenzellen verbinden und Teil der Blut-/Hirn-Schranke sind. Der Verlust der funktionellen Integrität der Blut-/Hirn-Schranke verursacht Neurodegeneration und Astrogliose.
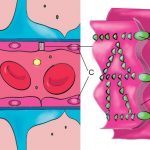
Abb. Die Tight Junctions zwischen benachbarten Endothelzellen versiegeln die Kontaktstelle und verhindert damit den Übertritt von Molekülen und Ionen aus den Blutgefäßen ins Gehirn und umgekehrt. A: Gehirn; B: Blutgefäß; C: Endothelzelle; D: Tight Junction; E:Endothelzellmembranen.
(Yun Jiang)
Das wesentliche Element der Blut-Hirn-Schranke bilden die Endothelzellen mit ihren Tight Junctions. Für Funktion sowie Aufbau und Entwicklung der Blut-Hirn-Schranke sind jedoch noch zwei andere Zelltypen, die Perizyten und die Astrozyten, von großer Bedeutung. Die Zell-Zell-Interaktionen zwischen Endothelzellen, Perizyten und Astrozyten sind so eng wie bei sonst keinen anderen Zellen. Diese drei Zelltypen zusammen bilden die endotheliale Blut-Hirn-Schranke.

Abb. zytoplasmatischer Astrozyt mit Endfeet-Fortsätzen für die Verbindung mit den Hirnkapillarendothelzellen
Der protoplasmatische Astrozyt enthält MAOB. Bei vermehrter MAOB-Expression, wie zum Beispiel bei der Alzheimer Krankheit mit spätem Beginn, wird der regulatorische Einfluss des protoplasmatischen Astrozyten auf die Endothelzellen unterbrochen und die physikalische Barriere der Endothelzellen verhindert nicht mehr, dass schädliche Stoff aus der Umwelt oder aus der Nahrung über die Blutbahn ins Gehirn gelangen können. Neuroinflammation ist die Folge.
Die tägliche Einnahme von EBP®- Epigenetic Brain Protector schützt die Gehirnzellen vor Neurodegeneration und Neuroinflammation und sorgt für ein Älterwerden in Gesundheit.

NUGENIS wurde 2015 auf der wichtigsten internationalen Fachmesse für „Ideen, Erfindungen, Neuheiten“, der iENA, für den EBP® – Epigenetic Brain Protector mit einer Goldmedaille für hervorragende Leistungen zum Schutz der Gehirnzellen ausgezeichnet.
Der EBP® – Epigenetic Brain Protector besteht aus im Körper natürlich vorkommenden Substanzen
-
Ademetionin (S-Adenosylmethionin)
Die Produktion von S-Adenosylmethionin (Ademetionin) beim Menschen findet hauptsächlich in der Leber statt.
Ein lebergesunder, unter 30 Jahre alter Erwachsener synthetisiert ungefähr 8 Gramm S-Adenosylmethionin (Ademetionin) pro Tag.
Das natürliche Vorkommen von Ademetionin in der Zelle und seine Biosynthese in den Leberzellen, nehmen mit dem 35. Lebensjahr ab.
Dieser vom Lebensalter abhängige Ademetionin-Mangel führt zu Hypomethylierung (Untermethylierung) der DNA und hat Krankheiten zur Folge.
Zu ihrem Vorteil verwenden wir:
ADOGRAN® ist ein gecoatetes (säure- und wasserfestes) Granulat von Ademetionin. Eine säurefeste Kapsel-Hülle schützt zusätzlich die Integrität der aktiven Form von S-Adenosylmethionin (Ademetionin).
-
Vitamin B12
unterstützt die Stoffwechselfunktionen unserer Gehirnzellen, welche die normale Funktion des Nervensystems und die normalen psychischen Funktionen erhalten
(nach Verordnung (EU) Nr. 432/2012). Vitamin B12 unterstützt die Ademetionin-Produktion.
Zu ihrem Vorteil verwenden wir:
Vitamin B12 liegt in unserem Produkt als HYDROXOCOBALAMIN vor. Unter allen Vitamin B12-Formen hat Hydroxocobalamin die beste Depotwirkung in der Gehirnzelle. Es bindet sich besonders gut an die Transportmoleküle des Körpers, so dass es sehr lange im Blut zirkuliert und problemlos in den Organen (Nerven, Muskel, Gehirn) in eine der bioaktiven Formen Methylcobalamin oder Adenosylcobalamin spontan umgewandelt werden kann.
-
Folsäure
trägt zu einer normalen Aminosäuresynthese bei und unterstützt die dispositionelle Bereitstellung der essentiellen Aminosäure Methionin im Kohlenstoff 1-Zyklus.
Folsäure trägt zu einem normalen Homocystein-Stoffwechsel bei, wobei der Risikofaktor der Hyperhomozyteinämie vermieden werden kann.
Folsäure trägt zur normalen psychischen Funktion bei, da es Methionin bereitstellt und für genügend Ademetionin-Synthese sorgt.
Folsäure trägt zu einer normalen Funktion des Immunsystems bei.
(nach Verordnung (EU) Nr. 432/2012)
Zu ihrem Vorteil verwenden wir:
QUATREFOLIC® (das Glucosaminsalz von 5-Methyltetrahydrofolat).
Die Methyltetrahydrofolatreduktase (MTHFR) katalysiert die Synthese von 5-Methyltetrahydrofolat, einem Methylgruppen-Spender für die Methioninsynthese.
L-Methionin ist ein Vorläufer von Ademetionin.
Die häufigste Mutationsvariante bei der Folsäure ist eine Punktmutation in Position 677. So findet sich bei homozygoten (zwei identische Allele) Trägern des Erbmerkmals, bei 5 bis 20% der Bevölkerung, ein 50%iger Aktivitätsverlust.
Dieser Polymorphismus im MTHFR-Gen vom Typ 677T führt oft zu milden bis moderater Erhöhung der Homozysteinkonzentration im Plasma, speziell bei niedrigem B12- oder Folsäure-Status.
Eine Hyperhomozysteinämie ist ein etablierter Risikofaktor für kardiovaskuläre Erkrankungen, nichtalkolische Fettleber und verursacht nachweislich Alzheimer-Pathologie.
Quatrefolic® (das Glucosaminsalz von 5-Methyltetrahydrofolat) ist die sogenannte vierte Generation des Folats. Seine hohe Bioverfügbarkeit vermeidet eine Hyperhomocysteinämie.
-
Vitamin B6
trägt zur normalen psychischen Funktion bei.
Vitamin B6 trägt zu einem normalen Homocystein-Stoffwechsel bei.
Vitamin B6 trägt zur Verringerung von Müdigkeit und Ermüdung bei.
(nach der Verordnung (EU) Nr. 432/2012)
Zu ihrem Vorteil verwenden wir:
VITAMIN B6 liegt in unserem Produkt in seiner aktivierten Form als PYRIDOXAL-5-PHOSPHAT (P5P) vor und baut Homocystein ab.
Gemeinsam verhindern Ademetionin, Hydroxocobalamin, Quatrefolic® und Pyridoxal-5-Phosphat einen Anstieg des Homocystein-Spiegels im Blut und leisten so einen wichtigen Beitrag zur Sicherheit der körperlichen und geistigen Gesundheit.
-
Zink
trägt dazu bei, die Zellen vor oxidativem Stress zu schützen (nach der EU-Verordnung Nr. 432/2012). Oxidativer Stress ist die Hauptursache des Alterns der Zellen.
Hersteller und Vertrieb:
NUGENIS GmbH, c/o LEBENSAFT, Prinz Eugen-Straße 66, A-1040 Wien, Österreich
Ihr Eduard Rappold
