
Altern (Seneszenz) und Epigenetik
ALTERN
Die Alterung ist gegenwärtig eines der aktivsten Forschungsgebiete, und es wird immer deutlicher, dass das Verständnis der zellulären Signalwege des Alterns für die Vorbeugung und Therapie altersbedingter Krankheiten unverzichtbar ist.
Eine einfache Definition von Alterung ist der Verlust von Stabilität und Erneuerungsfähigkeit von Geweben. Gealterte Zellen bezeichnet man als seneszent.
Merkmale seneszenter Zellen sind unter anderem eine verringerte Proliferationsfähigkeit, eine veränderte Interaktion mit der direkten Umgebung durch Modulation sekretierter Proteine, sowie eine Abnahme der Proteinqualität.
Die Charakterisierung der verschiedenen Kennzeichen der Alterung zeigt, dass diese oft miteinander wechselwirken und zusammenhängend betrachtet werden müssen. Zum einen gibt es Beobachtungen, die darauf hindeuten, dass die fehlende Aktivität des Telomerase-Proteins telomerase reverse transcriptase (TERT) zuerst die mitochondriale Dysfunktion auslöst, und erst darauffolgend Effekte wie DNA-Schäden und Induktion von Alterungsphänotypen auftreten. Als weiteres Beispiel induziert der Zellzyklusregulator p21 durch seine Wirkung als Inhibitor der cyclin-dependent-kinase 2 (CDK2) zelluläre Seneszenz.
Parallel dazu nimmt die Produktion von reaktiven Sauerstoffspezies (reactive oxygen species, ROS) in Mitochondrien stark zu, da im Alter die MAO B-Expression (-Aktivität) auf das 4 bis 5-fache erhöht ist.
Die erhöhte ROS-Produktion führt unter anderem zur akkumulativen Schädigung des Genoms und fördert so eine stärkere Seneszenz der Zelle. Eine Reduktion der Mitochondrienmasse reduziert die Ausprägung der Seneszenz und könnte so die Alterung verzögern (Zhang Y, Huang F, Wang J, Peng L, Luo H. MiR-15b mediates liver cancer cells proliferation through targeting BCL-2. Int J Clin Exp Pathol. 2015;8:15677–83). Eine sehr unglückliche Fehlannahme, denn die Anzahl der Mitochondrien ist für die lebenswichtige ATP-Bereitstellung unabdingbar und sie übersieht den wahren Grund für die mitochondriale Dysfunktion, die mitochondriale MAO-Überaktivität im Alter, die zur ROS-Belastung führt und das Mitochondrium unmittelbar schädigt und eine epigenetische Ursache als Methylierungsdefizit der Erbsubstanz hat. Doch neben der Mitochondrienmasse ist auch die Stabilität des mitochondrialen Genoms von entscheidender Bedeutung. Die fehlende Qualitätssicherung des mitochondrialen Genoms führt zu einer stärkeren Akkumulation von seneszenten Zellen in vivo und in vitro. Es spielen Mechanismen der Qualitätskontrolle in der Zelle eine besondere Rolle.
Biologisches Alter
Alle Menschen altern, aber wie wir altern und wie schnell, ist von Person zu Person sehr unterschiedlich. Diese Abweichung zwischen scheinbarem Alter und chronologischem Alter wird oft als „biologisches Alter“ bezeichnet.
Epigenetische Uhren, die als leistungsstarke Werkzeuge zur Untersuchung von Gesundheit, Entwicklung und Alterung über die gesamte Lebensspanne dienen, nutzen vorhersagbare Veränderungen im Epigenom, normalerweise DNA-Methylierung, um das chronologische Alter mit beispielloser Genauigkeit zu schätzen. Noch wichtiger ist, dass Abweichungen zwischen dem epigenetischen Alter und dem chronologischen Alter eine breite Palette von Gesundheitsfolgen und Mortalitätsrisiken besser vorhersagen als das chronologische Alter allein.
Alterungstheorien beschäftigen sich seit langem mit Möglichkeiten, wie die genomische Integrität fortschreitend verloren gehen kann, beispielsweise durch die Akkumulation von Mutationen oder die Verkürzung der Telomerkappen von Chromosomen. Diese Beobachtung der Verschiebung der DNA-Methylierung stärkte die aufkommende Idee, dass epigenetische Störungen das Altern durch zunehmende Dysregulierung der Genexpression vorantreiben können.
Die biologische Alterung oder Seneszenz ist mit einem Rückgang der physiologischen Funktion, einer veränderten Immunfunktion, einem erhöhten proinflammatorischen Status und einer erhöhten Anfälligkeit für Pathologien wie Herz-Kreislauf-Erkrankungen, Krebs, Gebrechlichkeit, Sarkopenie, Immobilität und metabolischen und neurodegenerativen Erkrankungen, die mit kognitiver Beeinträchtigung verbunden.
Stress und Hypothalamus-Hypophysen-Nebennieren-Achsen (HPA)-Aktivität im Alter
Die Hypothalamus-Hypophysen-Nebennierenrinden-Achse (HPA-Achse) wird für die Stressanpassung benötigt. Die Aktivierung der HPA-Achse verursacht die Sekretion von Glukokortikoiden, die auf mehrere Organsysteme einwirken, um Energieressourcen umzuleiten, um den tatsächlichen oder erwarteten erhöhten Bedarf zu decken.
Eine überaktive HPA-Achse fördert durch die vermehrte Glukokortikoid-Bereitstellung die Monoaminoxidase- Expression und damit die Generierung der mitochondrialen Dysfunktion (epigenetisch erworbene Mitochondriopathie), denn das aus der Nebennierenrinde freigesetzte Cortisol fördert die MAO B-Expression und verursacht chronisch-toxischen Stress mit überaktiver HPA-Achse.
Eine überaktive HPA-Achse liefert den Organismus den eindeutig katabolen Wirkungen von Glukokortikoiden aus, die wichtigen physiologische Systeme schädigen können.
Beispielsweise üben Glucocorticoide ausgeprägte katabole Wirkungen auf hippocampale Neuronen aus und folglich korreliert die Glucocorticoidkonzentration mit der Abnahme der neuronalen Dichte im Hippocampus über die gesamte Lebensdauer.
Beim Menschen ist das Altern mit erhöhten Cortisolspiegeln, einer erhöhten Cortisolproduktion und erhöhten Cortisolreaktionen auf „stressende“ kognitive Herausforderungen verbunden. Das Altern erhöht die Gesamt-Cortisol-Exposition durch Beeinträchtigung der HPA-Feedback-Hemmung. Diese höheren Cortisolspiegel sind auch mit einem erhöhten kognitiven Verfall bei älteren Menschen verbunden.
Wie man mit zunehmendem Alter erwarten kann, gibt es deutliche individuelle Unterschiede in den Alterseffekten auf der HPA-Achse: Bei einigen Personen wird eine ausgeprägte HPA-Achsen- Hyperaktivität beobachtet, während andere die normale Funktion der HPA-Achse während des gesamten Lebens beibehalten. Wichtig ist, dass die HPA-Achsen-Hyperaktivität mit negativen Ergebnissen auf Langlebigkeit korreliert.
Das Altern neigt dazu, die Variabilität der HPA-Achsenreaktivität zu erhöhen. Genetik und Lebensgeschichte (z. B. Mutterschaft und perinatale Umgebung, kumulative Stressexposition) können eine Dysregulation der HPA-Achse prädisponieren oder davor schützen, abhängig von den Herausforderungen, denen sich die ältere Person gegenübersieht zu sein.
Epigenetik und Altern, Entzündungen und Dysregulation des Immunsystems
Es wurde gezeigt, dass chronische Entzündungen eng mit altersbedingten Pathologien assoziiert sind, und interessanterweise korreliert jede dieser Pathologien stark mit epigenetischen Veränderungen.
Es gibt zunehmend Hinweise darauf, dass epigenetische Mechanismen der Entwicklung altersassoziierter chronischer Krankheiten zugrunde liegen.
Die Prävalenz altersassoziierter Krankheiten und die Lebenserwartung sind sehr unterschiedlich, selbst in Ländern und Gebieten mit ähnlichen sozialen und wirtschaftlichen Bedingungen. Unterschiede in den Ernährungspräferenzen, es ist schon lange bekannt, dass Ernährungsgewohnheiten zu den vielen Faktoren des Lebensstils gehören, die eine Rolle bei der Hemmung von altersassoziierten Krankheiten und Seneszenz spielen.
Es hat sich gezeigt, dass Entzündungen und der daraus resultierende Anstieg des oxidativen Stresses zu den meisten, wenn nicht aller altersbedingten chronischen Erkrankungen beiträgt. Darüber hinaus ist das Altern selbst mit einem proinflammatorischen Status verbunden, z. B. einer Dysregulation des Immunsystems, die zu chronischen leichten Entzündungen und anhaltendem oxidativem Stress führt und mit altersbedingten Funktionseinbußen sowie mit erhöhten Morbiditäts- und Mortalitätsrisiken verbunden ist.
Auch die altersbedingten Veränderungen der DNA-Methylierung, insbesondere der DNA-Hypomethylierung haben sich als mechanistischer Zusammenhang zwischen Alterung und Autoimmunität herausgestellt und die DNA-Methylierung spielt eine wichtige Rolle bei der epigenetischen Regulation adaptiver Reaktionen des Immunsystems und man weiß, dass Gene, die für die T-Zell-Differenzierung wichtig sind, durch epigenetische Prozesse während des Alterns unterschiedlich exprimiert werden.
Außerdem scheint die altersbedingte Demethylierung auf die Immunkompetenz und die Häufigkeit der Autoimmunität bei älteren Menschen Einfluss zu nehmen und kann zu Krankheiten wie rheumatoider Arthritis beitragen und kurioserweise kann sich im Alter von über 90 Jahren noch einen Typ-1-Diabetes entwickeln.
Antioxidantien
Vor diesem Hintergrund haben in Lebensmitteln enthaltene Substanzen, die den altersbedingten proinflammatorischen Status hemmen oder entgegenwirken und die daraus resultierende Erhöhung des oxidativen Stresses verringern, das sind Chemikalien, die die Übertragung von Elektronen von einer Substanz auf ein Oxidationsmittel hemmen, das Interesse der Wissenschaftler geweckt.
Unter diesen Substanzen gelten die antioxidativen Polyphenole als wichtige Kandidaten für die Verlängerung der gesunden Lebensspanne. Beispiele hierfür ist das Isoflavon Genistein, das in hohen Konzentrationen in Sojabohnen vorkommt und Resveratrol, aus der roten Weintraube (Haut und Kerne), das in der mediterranen Ernährung weit verbreitet ist. Beide haben beispielsweise antioxidative und entzündungshemmende Eigenschaften und schützen Zellen und Gene vor schädlichen Einflüssen.
Biologisches Rauschen
Die Schwierigkeit bei den epigenetischen Mechanismen besteht darin, dass wichtige Gene – wie beispielsweise Transkriptionsfaktoren, die vermitteln, welche Gene ein- oder ausgeschaltet werden sollen, bei der Zelldifferenzierung häufig nur schwach exprimiert werden, teilweise mit hoher Variabilität in Zellen des gleichen Typs. Die Forschung spricht hierbei vom sogenannten „biologischen Rauschen“. So könnte eine vermutete Ursache des Alterns die Akkumulation von epigenetischem Rauschen sein, das das Genexpressionsmuster stört, was zu einer Abnahme der Organfunktion und der Regenerationsfähigkeit führt.
Eine erhöhte Mao B- Expression findet sich im Alter
Die MAO B-Expression beim Menschen steigt beim Altern um das 4- bis 5-fache an und führt zu deutlich erhöhter MAO B- Aktivität.
Schon 1997 vermutete JS Fowler: „Die Monoaminooxidase B- (MaoB)- Aktivität ist im Gehirn alter Menschen deutlich erhöht und es besteht die Vermutung, dass die Monoaminooxidase B (Mao B) eine Rolle im Alterungsprozess spielt“.
Die im Alter erhöhte zerebrale MAO B -Aktivität wie auch der verminderte Gehalt an reduziertem Glutathion erhöhen den Wasserstoffsuperoxydgehalt und trägt somit zu vermehrter oxidativen Stress (ROS)- Belastung bei.
Risikofaktoren für das Alter sind die Hypomethylierung und die DNA-Demethylierung
Es ist klar, dass das Altern das Epigenom des Menschen beeinflusst, einschließlich die Hypomethylierung der DNA und Histonproteine.
Die DNA-Methylierung ist ein entscheidender biologischer Prozess, der die Aufrechterhaltung der genomischen Integrität und die genaue Expression genetischer Informationen kontrolliert.
Der genaue Status der DNA-Methylierung ist in reifen Zellen ausgeglichen, aber mit zunehmendem Alter verschiebt sich dieses Gleichgewicht stark zugunsten der DNA-Demethylierung. Daher wird die DNA-Hypomethylierung, die während des normalen Alterns auftritt, ein kritischer Risikofaktor.
(-) S-Adenosyl-L-Methionin (Ademetionin) ist der singuläre Methylgruppendonor für die nukleare DNA (nDNA) und mitochondriale DNA (mtDNA).
Bei (-) S-Adenosyl-L-Methionin-Mangel kommt es zu vermehrter MAO A- und MAO B-Expression und zum Aktivitätsanstieg der MAO A und MAO B.
Mitochondriale Dysfunktion im Alter
Mitochondrien stehen unter dem Generalverdacht, Verursacher von Alterungsprozessen zu sein.
Die wissenschaftliche Evidenz, dass Altern mit Schädigung und Funktionsstörung der Mitochondrien einhergeht, ist überwältigend. Schon 1992 konnte in mehreren humanen postmitotischen Geweben (u. a. Gehirn und Muskel) gezeigt werden, dass es im Rahmen des Alterns zur Akkumulation von mitochondrialen DNA- (mtDNA)- Mutationen und -Deletionen kommt, was zur Frage führte: „Growing old: the most common mitochondrial disease of all?“.
Diese mitochondriale DNA-Schädigung führt zu vorzeitig einsetzendem Altern unterschiedlicher Organsysteme sowie zu einer reduzierten Lebensspanne.
Eine Verringerung der mitochondrialen Atmung um etwa 10% pro Jahrzehnt und eine Abnahme der ATP- Produktion mit zunehmendem Alter unterstützt die Theorie des mitochondrialen Alterns. Dieser Alterungs-Phänotyp ist verbunden mit einer kontinuierlichen Abnahme der Atmungskettenfunktion und es kommt zu einer verminderten ATP-Produktion.
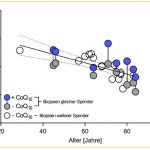
Abb. Biopsien aus menschlichem Epithelgewebe. Es kommt pro Lebensjahrzehnt zu einer 10% Abnahme der ATP-Produktion (weiße und graue Kreise, mit Q10 behandelte Proben sind blau dargestellt). Schniertshauer et al.,2018.
Mitochondriale Theorie von Altern und Neurodegeneration (Harman 1972)
Die mitochondriale Theorie von Altern und Neurodegeneration von Harman postuliert einen molekularen Teufelskreis, in dem sich oxidativer Stress und Schäden an mitochondrialen Proteinen und mitochondrialer DNA (mtDNA) gegenseitig verstärken.
Die Folge ist eine mitochondriale Funktionsstörung und eine verminderte Expression von mitochondrial kodierten Atmungskettenuntereinheiten. Dies bewirkt eine Störung des Elektronenflusses durch die Atmungskette und dadurch eine weitere vermehrte reaktive Sauerstoffspezies (ROS)-Produktion.
Bei Überschreiten eines bestimmten Schädigungsschwellenwertes (ca. 60-85% aller mtDNA-Moleküle einer Zelle) kommt es zu einer Funktionsstörung der Mitochondrien und letztendlich zum Untergang der betroffenen Zellen, was sich nach außen als „normales Altern“, (auf Zellebene als physiologischer Alterungsprozess, aber auch als noch asymptomatische Neurodegeneration) oder aber als „neurodegenerative Erkrankung“ mit manifesten Symptomen äußert. Postmitotische Gewebe mit hohem Energiebedarf, wie Gehirn, Leber, Retina und Skelettmuskel/Herzmuskel sind besonders von diesem Teufelskreis betroffen, da sie einen hohen Sauerstoff-Umsatz haben und geschädigte Zellen nicht in relevantem Umfang erneuert werden können.
Stressbedingte vorzeitige Seneszenz in Herzzellen durch erhöhte MAO A
MAO A -SIPS (stress‐induced premature senescence) steuert in Herzzellen zur ROS-Produktion, mitochondriale Dysfunktion und zur Parkin-vermittelte Mitophagie-Hemmung bei.
Die zelluläre Seneszenz, der in somatischen Zellen beobachtete irreversible Zellzyklusstillstand, ist ein wichtiger Treiber für altersassoziierte Krankheiten. Mitochondrien sind in dem Seneszenz-Prozess verwickelt, hauptsächlich, weil sie sowohl Quellen als auch Ziele von reaktiven Sauerstoffspezies (ROS) sind. Als Beispiel ist das mitochondriale Enzym Monoaminoxidase-A (MAO A) eine relevante Quelle für reaktiven Sauerstoffspezies (ROS) im Herzen durch die Bildung von Wasserstoffperoxid (H2O2), das aus dem Abbau (oxidativer Desaminierung) seiner Hauptsubstrate Noradrenalin und Serotonin stammt und zur zellulären Seneszenz am Herzen führt.
Altersbedingte Makuladegeneration (AMD)
An der Pathogenese der altersbedingten Makuladegeneration ist die DNA-Hypomethylierung beteiligt.
Die altersbedingte Makuladegeneration (AMD) ist die häufigste Ursache für eine irreversible Blindheit bei Menschen ab 50 Jahren und kann nicht wirksam geheilt werden. Die Krankheit ist gekennzeichnet durch die fokale Ablagerung von azellulären polymorphen Trümmern, Drusen genannt, zwischen retinalem Pigmentepithel (RPE) und Bruch-Membran.
Eines der in Drusen akkumulierten Hauptproteine ist Clusterin, dessen Expression durch Promotor-Methylierung reguliert wird. Auch gibt es zahlreiche Hinweise, dass die durch oxidativen Stress aus der Atmungskette der Mitochondrien verursachten Störungen eine weitaus größere Bedeutung bei der Entstehung der AMD haben, als bislang angenommen. Gerade der oxidative Stress führt bei AMD-Patienten zu gravierenden DNA-Schäden der mitochondrialen DNA. Sowohl Alter und Rauchen sind bestätigte Risikofaktoren für altersbedingte Makuladegeneration.
Literaturangaben sind auf Anfrage erhältlich.
Ihr
Eduard Rappold
(-)-S-Adenosyl-L-Methionin (Ademetion) rangiert neben ATP als ein Schlüsselmolekül in der Biologie
EBP© – Epigenetic Brain Protector
EBOP©- Epigenetic Burnout Protector
ECP©- Epigenetic Cartilage Protector
Ademetionin liegt hier in seiner biologisch aktiven (S,S) Form in präventiver Dosierung von 400 mg pro Kapsel vor.
Ademetionin ist der singuläre Methylgruppendonor bei der Transmethylierung an die Erbsubstanz (DNA + Histone).



Auf der NUGENIS – Webseite
www.nugenis.eu + Shop
 Sojapulver
Sojapulver
Spermidin + wertvolles Sojaprotein
Spermidin erhöht die allgemeine Proteinsynthese um das 1,5- bis 2,0-fache.
Schützt so vor altersbedingten Muskelverlust (Sturzgefahr).
Spermidin induziert die Autophagie und schützt die Zellen.
+
Sojaprotein enthält essentielle Aminosäuren
mit dem idealen Aminosäure-Score von 100
Isoflavone aus Sojabohnen wie Genistein waren und sind seit Jahren Teil der
menschlichen Ernährung ohne Anzeichen auf negative Effekte.
Als natürlicher selektiver Östrogenrezeptormodulator kommt es am Knochen zur
Prävention der Osteoporose.
Sojaverzehr mit seinem Genistein
reduziert signifikant das Risiko für ein Prostatakarzinom
www.nugenis.eu + Shop
spermidine-soyup.com
