Die Angst und ihre Serotoninmangel-Familie: Furcht, Zwang, Burnout und Depressionen. Epigenetik kann helfen
Ein funktioneller Serotoninmangel, bei normalem Serotonin-Plasmaspiegel, führt zu verminderter chemischen Informationsübertragung an den Rezeptoren der serotoninergen postsynaptischen Membran und steht in Zusammenhang mit Angsterkrankung, Zwangsstörung, toxischem Stress, Burnout und Depression.
Serotonin ist das phylogenetisch älteste und in allen Teilen des Gehirns wirkende Neurotransmittersystem. Im embryonalen Alter von fünf Wochen entstehen die ersten serotonergen Neurone und beginnen mit der Serotoninsynthese.
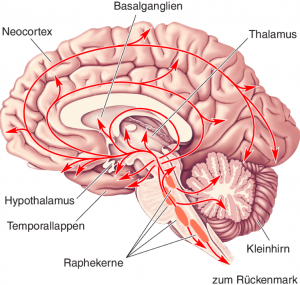
Abbildung stammt aus: Mark F. Bear. Neurovegetative und modulatorische Systeme. Neurowissenschaften 2018, pp 559-589.
Zwei der überzeugendsten biologischen Korrelate von Stimmungsstörungen (Depressionen) sind eine niedrigere Serotonin – Funktion und eine veränderte Aktivität der Hypothalamus-Hypophysen-Nebennieren- Stress – Achse.
Eine plausible Erklärung ist, dass Umweltstressoren das Serotoninsystem durch epigenetische Prozesse umprogrammieren, indem sie die Genexpression des Serotoninsystems verändern.
Salutogenetische Beziehungskultur und ihre Selbstheilungskräfte brauchen Serotonin und Oxytocin und ermöglichen Empathie.
Das Verständnis der Neurobiologie und Neurogenetik von sozialer Kognition und sozialem Verhalten hat wichtige klinische und gesellschaftliche Auswirkungen.
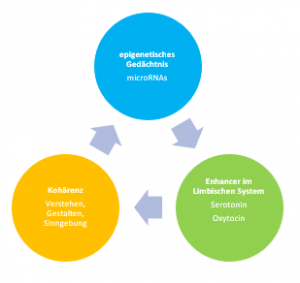
Angesichts der zentralen Rolle des Oxytocin – Systems in Bezug auf soziales Verhalten, Bindung, Angst und Stressverarbeitung ist das Oxytocin-Rezeptor – Gen ein Schlüsselkandidatengen für die molekulargenetischen Grundlagen der verhaltensbezogenen und psychologischen Folgen von Verlusterlebnissen.
Die soziale Erkennung wird durch ein Netzwerk von Oxytocin-sensitiven Neuronen im Hippocampus reguliert. Ausreichend Serotonin im Gehirn führt zu einem Oxytocin -(„Kuschelhormon“ ) – Anstieg.
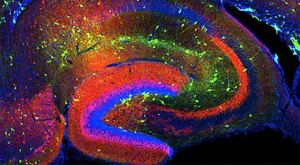
Abb. Oxytocin-sensitive Neurone des Hippocampus ermöglichen soziale Anerkennung.
Oxytocin ist der vermutlich bindungsstiftendste Neurotransmitter, der bisher beim Menschen gefunden wurde.
„Die Grundbefindlichkeit des Menschen ist die Angst! „ (Martin Heidegger).
Die Zahl Angsterkrankter ist besorgniserregend. Angsterkrankungen zählen zu den häufigsten psychischen Störungen und haben einen frühen Krankheitsbeginn.
Angst ist eine unangenehme Emotion, die das Vermeiden potenziell schädlicher Situationen motiviert.
Eine Trias von Hirnregionen reguliert unsere Angst/Furchtreaktionen:
- Der linke Mandelkern(Amygdala) ist das sogenannte Angstgedächtnis
Depression führt zu Amygdala-Hyperaktivität und zu Neuronenverlust.
- Der Hippocampus ist eine Hauptstruktur innerhalb des limbischen Systems, von der bekannt ist, dass sie sehr anfällig für toxischen Stress und andere epigenetisch sich auswirkende Umweltfaktoren ist.
- Der Präfrontalcortex fungiert als eine Art übergeordnete Instanz, die das Ereignis bewertet und das Furchtgedächtnis und damit die Furcht aktiv unterdrücken kann.
Kritisch wird es, wenn diese Hirnregionen fehlreguliert werden. Zum Beispiel zeigen Traumapatienten hyperaktive Antworten der Amygdala bei gleichzeitig reduzierter Aktivität im Präfrontalcortex. Die hieraus resultierende Dysbalance der Hirntrias geht mit extremen Furchtreaktionen einher.

Abb: Ein „Regenschirm aus microRNAs“ schützt uns vor dem „täglich auf uns einprasselnden Regen“ von Stress, Herausforderungen oder negativen Gefühlen und psychischen Erkrankungen wie Depression oder Angststörungen.
© Graphikabteilung Weizmann Institute of Science / Brodsky
Ein „Regenschirm aus microRNAs“ schützt uns vor dem „täglich auf uns einprasselnden Regen“ von Stress, Herausforderungen oder negativen Gefühlen und psychischen Erkrankungen wie Depression oder Angststörungen.
Es wurde eine spezielle microRNA identifiziert (miR135), die im Gehirn und im Blut von depressiven Patienten im Vergleich zu Kontrollprobanden in geringeren Mengen vorkommt. Diese mircoRNA reduziert die Herstellung von zwei Proteinen aus dem Serotoninsystem.
Das eine Protein, der Serotonintransporter, ist ein Angriffspunkt vieler der derzeit verfügbaren Antidepressiva aus der Gruppe der Serotonin Reuptake Inhibitoren (SRI´s). Der Serotonintransporter als „Recycling-Gerät“ transportiert freies Serotonin aus dem synaptischen Spalt zurück in die Präsynapse, wo es abgebaut wird und nicht mehr wirken kann.
Das zweite Protein, der Serotonin1A – Rezeptor ist ein Protein in der Zellmembran der Nervenzellen und dient als Serotonin-Fühler. Agonisten am Serotonin1A – Rezeptor, wie das Serotonin selbst, haben hemmende, potenziell angstlösende Wirkung. Da durch den Einfluss der miR135 weniger Serotonin-Transporter und Serotonin1A – Rezeptor im Gehirn vorhanden sind, steigt der Serotoninspiegel an. MiR135 wirkt daher wie ein Serotonin Reuptake – Inhibitor, nach deren Einnahme die Symptome einer Depression abklingen sollen. Es gibt die therapeutische Anwendung dieser mikroRNA noch nicht.
Meditation reduziert Angststörung
Forscher entdeckten, dass meditationsgebundene Angstentlastung mit einer Aktivierung der Bereiche mit den exekutiven Funktionen des präfrontalen Cortex verbunden ist.
Während der Meditation gab es mehr Aktivität im ventromedialen präfrontalen Cortex, dem Bereich des Gehirns, der Sorge und Angst kontrolliert.
Zwangsstörungen sind nicht selten. Etwa 2-3% der Bevölkerung leiden daran, damit sind sie die fünfthäufigste psychische Erkrankung. Die Komorbidität mit einer Angststörung ist sehr hoch.
Die epigenetische Ursache der Zwangsstörung findet sich in einer vermehrten Expression der Serotonin-Transporter – Gene.
Zunahme der Expression des Serotonintransporter -Gens verursacht eine Zunahme der Anzahl von Serotonin-Transportern. Mit mehr Serotonin-Transportern wird mehr Serotonin in die Präsynapse wiederaufgenommen, förmlich aus dem synaptischen Spalt in die Präsynapse „abgesaugt“, was letztendlich zu einer Verringerung von Serotonin im synaptischen Spalt führt.
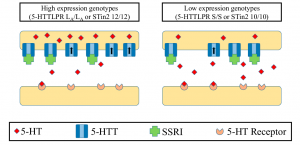
Abb. Serotonin-Transporter (SLC6A4) – Polymorphismen. Zwei polymorphe Stellen mit den Bezeichnungen 5-HTTLPR und STin2 haben funktionelle Konsequenzen.
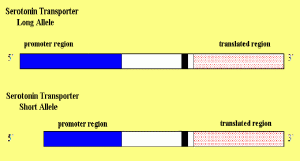
Abb.: Der Unterschied zwischen beiden Serotonin-Transportern liegt nicht in der Information zur Herstellung des Transporters selbst (der „translatierenden Region“), sondern in dem Teil des Gens, der steuert, wie oft die translatierende Region gelesen wird, nämlich der „Promotorregion“.
Diese Varianten des Serotonin-Transporter- Gens beeinflussen Persönlichkeitsmerkmale und psychiatrische Erkrankungen.
Sie sind ängstlich, wenn Sie das Short / Short-Paar für den Serotonin-Transporter erben und sie werden daher weniger in der Lage sein, ängstliche Situationen bei Konflikten, Traumata und Verlusten zu bewältigen. Es könnte also sein, dass kurze Serotonintransporter – Allele zu einem erhöhten Risiko für Depressionen führen.
Auch schädigende soziale Erfahrungen während kritischer frühkindlicher Entwicklungsperioden, Kindesmissbrauch oder Vernachlässigung, führen zu permanenten Rezeptoren Veränderungen. Sie sind die Basis für die Anfälligkeit für posttraumatische Belastungsstörungen in der späteren Kindheit, in der Jugend und im Erwachsenenalter.
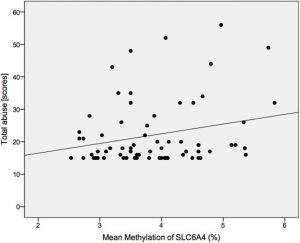
Abb.: Der Zusammenhang zwischen totalem Kindesmissbrauch und Methylierung des Serotonin-Transporter – Gens.
Burnout wird als Syndrom aufgrund von „chronischem Stress am Arbeitsplatz, der nicht erfolgreich verarbeitet wird“, definiert. Dabei sehen die Gesundheitsexperten drei Dimensionen der Krankheit: ein Gefühl von Erschöpfung, eine zunehmende geistige Distanz oder negative Haltung zum eigenen Job sowie verringertes berufliches Leistungsvermögen.
Depression ist die häufigste Erkrankung des Nervensystems
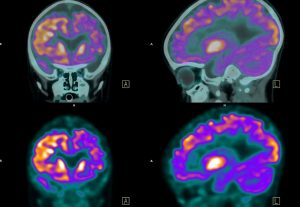
Bei Patienten mit schwerer depressiver Störung besteht eine Überexpression von MAO-B im Gehirn.
Serotonin spielt ebenso eine wichtige Rolle in der Ätiologie der Depression.
Eine plausible Erklärung ist, dass Umweltstressoren das Serotoninsystem durch epigenetische Prozesse umprogrammieren, indem sie die Genexpression des Serotoninsystems verändern. Dies kann wiederum die Entwicklung des Gehirns beeinflussen, einschließlich des Hippocampus, einer Region mit dichter serotonerger Innervation und wichtig für die Stressregulation ist.
Stressvolle Lebensereignisse stellen einen Hauptrisikofaktor dar, der die Anfälligkeit einer Person für Depressionen bestimmt.
Wie werden die Therapiemaßnahmen in der Zukunft sein?
Die Konzeptualisierungen der zugrunde liegenden Neurobiologie der Major Depression haben jetzt ihren Fokus von Störungen der Neurotransmission (Antidepressiva) auf Störungen der Neurogenese und Neuroprotektion verlagert.
Es wurde gezeigt, dass die Neurogenese durch körperlichen, psychischen und sozialen Stress, Depressionen, oxidativen Stress, eine Verringerung des neurotrophen Faktors aus dem Gehirn (BDNF) und durch Verkürzung der Telomere oder einer hohen Konzentration an Cortisol gehemmt wird.
Toxischer Stress führt zu einer Abnahme der Neuroneogenese im Gyrus dentatus des Hippocampus, was eine verringerte Proliferation, Überlebensrate und Differenzierung neuronaler Stammzellen zur Folge hat.
Toxischer Stress führt auch zu Hypomethylierung des Glucocortcoid – Rezeptor – Genortes und damit zu erhöhter MaoB- Expression.
Diese epigenetischen Veränderungen spielen eine Schlüsselrolle bei der Vermittlung des Stresses aus frühen Lebenphasen auf die spätere Entwicklung von Stress-Erkrankungen, einschließlich der Borderline Personality Disorder.
Neuroprotektion und seelische Gesundheit sind nur möglich mit dem angewendeten Wissen und den Mitteln der Epigenetik.
Eine mitochondriale Funktionsstörung bei der Depression startet die Generierung von toxischen oxidativen Zellstress (ROS) durch oxidative Desaminierung der Monoamine bei erhöhter MAOB-Expression und die konsekutive Einschränkung der oxidativen Phosphorylation durch die mitochondriale Selbstbeschädigung verursachte ATP-Mangel und führen letztendlich zu Mitochondrien- und Zell-Verlust.
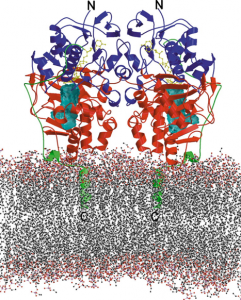
Abb.: Monoaminooxidase B (MAOB) findet sich an der äußeren Mitochondrien-Membran verankert und richtet sich in den Intermembranraum.
Im menschlichen Gehirn sind etwa 75% des MAO vom B-Subtyp (Saura Marti et al., 1990).
Der erhöhten Serotonin-Transporter-Gen -, Glucocorticoid-Rezeptor -Gen – und MAOB-Gen – Expression liegt ein Mangel an Ademetionin (S-Adenosylmethionin) zu Grunde, dem einzigen Methylgruppen – Spender an das Genom oder es ist das Alter, mit seiner MaoB- Erhöhung um das 3 – 4-fache, oder eine begleitende Alzheimerkrankheit mit spätem Beginn, oder toxischer Stress, oder Nikotin- und Alkohol-Missbrauch, PPI-Langzeiteinnahme und eine Langzeitcortison -Therapie, die neben den anderen epigenetisch wirkenden Einflussfaktoren in puncto Gesundheit, den Methylierungsgrad unserer Erbsubstanz so verändern, dass eine Untermethylierung die erste Ursache für Krankheiten ist.

Ihr Eduard Rappold
Alles was Sie über Ademetionin wissen sollten
