
Spermidin moduliert und stabilisiert RNA-Strukturen und erhöht die Proteinsynthese
Spermidin moduliert und stabilisiert RNA-Strukturen und erhöht die Proteinsynthese
Wechselwirkungen von Polyaminen, wie Spermidin mit Ribonukleinsäure (RNA) können den Gehalt einzelner Proteine auf vielfältige Weise beeinflussen, einschließlich Änderungen der ribosomalen Struktur, Erleichterung der Bildung von Initiationskomplexen und Ermöglichung des Durchlesens ineffizienter Initiationskomplexe. Spermidin, stimuliert den Aufbau von 30S-ribosomalen Untereinheiten und erhöht dadurch die allgemeine Proteinsynthese um das 1,5- bis 2,0-fache. Polyamine können den Proteingehalt auch über direkte und indirekte Auswirkungen auf die posttranslationale Proteinverarbeitung und den Proteinabbau beeinflussen.
Ribonukleinsäure ist eine Nukleinsäure, das heißt eine Kette aus vielen Nukleotiden.
Im internationalen und im wissenschaftlichen Sprachgebrauch wird die Ribonukleinsäure mit der englischen Abkürzung RNA (ribonucleic acid) bezeichnet, im deutschen Sprachraum auch mit RNS.
Eine wesentliche Funktion der RNA in der Zelle ist die Umsetzung von genetischer Information in Proteine. RNA ist hierbei sowohl als Informationsträger beteiligt (mRNA), als auch als katalytisches Molekül bei der Translation dieser Information in ein Protein (rRNA, tRNA).
Nukleinsäuren sind aus einzelnen Bausteinen, den Nukleotiden, aufgebaute Makromoleküle. Abwechselnde Einfachzucker und Phosphorsäureester bilden eine Kette, wobei an jedem Zucker eine Nukleinbase, nämlich Adenin (A), Guanin (G), Cytosin (C), Thymin (T) oder Uracil (U), hängt. In der RNA ist die Nukleobase Thymin (T) gegen Uracil (U) ausgetauscht.
Die Nukleotide unterscheiden sich also durch die Base, die jeweils eingebaut ist, und durch den Zucker (die Pentose), der bei der DNA die Desoxyribose und bei der RNA die Ribose ist.
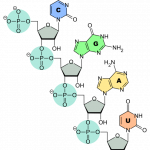
Abb. Verknüpfung der Nukleinbasen (C, G, A und U) über ein Zucker- (grau) und Phosphatrückgrat (türkis) zur RNA, https://de.wikipedia.org/wiki/Ribonukleinsäure
RNA-Moleküle sind – im Gegensatz zur doppelsträngigen DNA – in der Regel einzelsträngig. Die Einzelsträngigkeit erhöht die Zahl der Möglichkeiten für dreidimensionale Strukturen der RNA und erlaubt ihr chemische Reaktionen, die der DNA nicht möglich sind.
Das Enzym RNA-Polymerase katalysiert an der DNA durch den Prozess der Transkription aus Nukleosidtriphosphat (NTP) die RNA.
Beispiele unterschiedlicher RNA-Typen:
- Die mRNA, Boten-RNA (engl. messenger RNA) kopiert die in einem Gen auf der DNA liegende Information und trägt sie zum Ribosom, wo mit Hilfe dieser Information die Proteinbiosynthese stattfinden kann. Jeweils drei im Leseraster des Polynukleotidstrang nebeneinander liegende Nukleotide bilden ein Codon, mit dessen Hilfe sich eine spezifische Aminosäure, die in ein Protein eingebaut werden soll, eindeutig bestimmen lässt.
- Die tRNA, Transfer-RNA kodiert keine genetische Information, sondern dient als Hilfsmolekül bei der Proteinbiosynthese, indem sie eine einzelne Aminosäure aus dem Cytoplasma aufnimmt und zum Ribosom transportiert. Die tRNA wird durch ein bestimmtes ‚RNA-Gen‘ kodiert.
- Die rRNA, ribosomale RNA, trägt, ähnlich wie die tRNA, keine genetische Information, sondern ist am Aufbau des Ribosoms beteiligt und ist bei der Knüpfung der Peptidbindung auch katalytisch aktiv.
- Die siRNA, small interfering RNA, entsteht bei einem Signalweg der Zelle, der als RNAi (RNA Interference) zusammengefasst wird. Dabei wird dsRNA (doppelsträngige RNA; englisch double-stranded RNA) durch das Enzym Dicer in viele kleinere Fragmente von ca. 22 Nukleotiden Länge zerteilt (die siRNAs) und in den Enzymkomplex RISC (RNA-induced silencing complex) eingebaut. Mithilfe der inkorporierten RNA-Fragmente bindet RISC komplementär an DNA, z.B. Genbereiche, oder mRNA und kann diese damit „abschalten“.
- Die microRNAs sind eng verwandt mit den siRNAs und dient der Regulation zellulärer Prozesse wie z.B. Proliferation und Zelltod.
- Die Riboswitches dienen der Genregulation. Sie können entweder aktivierend oder reprimierend wirken.
- Die Ribozyme sind katalytisch aktive RNA-Moleküle. Sie katalysieren wie Enzyme chemische Reaktionen.
Die RNA-Welt-Hypothese
Die RNA-Welt-Hypothese wurde erstmals 1986 von Walter Gilbert vorgeschlagen und besagt, dass RNA-Moleküle in der chemischen Evolution die Vorläufer der Organismen waren.
Die Hypothese lässt sich ableiten aus der Fähigkeit der RNA zur Speicherung, Übertragung und Vervielfältigung genetischer Informationen sowie aus ihrer Fähigkeit, als Ribozyme Reaktionen zu katalysieren. In einer Evolutionsumgebung würden diejenigen RNA-Moleküle gehäuft vorkommen, die sich selbst bevorzugt vermehren.
2001 wurde entdeckt, dass die wichtigen katalytischen Zentren der Ribosomen von RNA und nicht, wie vorher angenommen, von Proteinen gestellt werden. Man ist nun sicher, dass RNA-Moleküle – zumindest prinzipiell – in der Lage sind, Aminosäuren zu Proteinen zu verketten. In diesem Zusammenhang ist auch die PNA (Peptid-Nukleinsäure) als mögliches Vorläufermolekül der RNA von Interesse.
Referenz:
- J. Marx: P- Bodies Mark the Spot for Controlling Protein Production. Science 2005; 4 Vol. 310. no. 5749, pp. 764 – 765.
RNA als Impfstoff
Einige der neu entwickelten Impfstoffe gegen das Corona-Virus (Sars-CoV-2) basieren auf der Boten-RNA (mRNA). Der genetische Code für bestimmte Virus-Proteine oder Teile davon wird in Form ihrer mRNA verabreicht. Sie gelangt in die menschlichen Zellen, die nun diese Virus-Proteine an dem zellulären Syntheseapparat mit der zentralen Synthesemaschine, dem Ribosom, im Zytoplasma herstellen und auf der Zell-Oberfläche präsentieren. Das Immunsystem erkennt das feindliche Protein und reagiert. Es produziert passende, gegen das Virus gerichtete Antikörper und aktiviert Immunzellen.
Die mRNA des Impfstoffs liefert lediglich die erforderliche genetische Information, sie wird in der Zelle rasch abgebaut und nicht in das menschliche Erbgut eingebaut. Aufgrund ihrer unterschiedlichen chemischen Struktur kann die einsträngige RNA nicht in doppelsträngige DNA integriert werden.
Künstlich hergestellte RNA als Gen-Schere CRISPR/Cas für eine präzise Mutation
Mit der Gen-Schere CRISPR/Cas können einzelne DNA-Bausteine, gezielt und punktgenau, verändert werden, Jennifer Doudna und Emmanuelle Charpentier, die beiden „Erfinderinnen“ des CRISPR/Cas-Verfahrens, erhielten dafür 2020 den Nobelpreis für Chemie.
Bei der neuen Genome Editing-Methode CRISPR/Cas9 spielt die sogenannte guide RNA (gRNA) – auch bekannt als sgRNA für single guide RNA – eine wichtige Rolle. Dabei handelt es sich um eine künstlich hergestellte RNA, welche aus natürlich vorkommenden RNA-Varianten (crRNA und tracrRNA) besteht. Bei einem Teil dieses RNA-Moleküls wird die Abfolge der Basen so zusammengesetzt, dass er genau zur Zielsequenz der zu verändernden Stelle im Genom passt. Ein anderer Teil der sgRNA bindet an das Protein Cas9, welches die Ziel-DNA schneidet.
RNA-Polyamin-Bindung und RNA-Struktur
Spermidin und Spermin bestätigen ihrer Rolle als unabhängige molekulare Einheiten, die dazu beitragen, RNA-vermittelte Prozesse voranzutreiben.
Spermidin und Spermin spielen eine wichtige Rolle als Modulatoren der RNA-Struktur und der strukturellen Integrität von RNA. Polyamine binden RNA sequenzselektiv und induzieren kontextabhängig Veränderungen der RNA-Struktur.
Spermidin und Spermin stabilisieren die RNA – Struktur
Spermidin ist in fast allen Geweben in Verbindung mit Nukleinsäuren zu finden. Es wird bei allen pH-Werten als Kation gefunden und soll dabei helfen, einige Membranen- und Nukleinsäurestrukturen zu stabilisieren.
Die Wechselwirkungen zwischen Polyaminen und Transfer-RNA- (tRNA) standen anfangs im Fokus. In den letzten zwei Jahrzehnten haben sich jedoch zahlreiche neue Studien auf das Verständnis der Wechselwirkungen und funktionellen Konsequenzen von Polyaminen konzentriert, die an zusätzliche verschiedene RNAs z. B. ribosomale RNA (rRNA), Ribozym, mRNA, kleine Kern-RNA (snRNA) und virale RNA binden.
Das „Polyamin-MODULON“ als RNA-Polyamin-Synthese-Komplex und erhöhte Proteinsynthese
Polyamine, wie Spermidin, stimulieren die Synthese von 20 verschiedenen Proteinen auf der Ebene der Translation, die stark am Zellwachstum und der Lebensfähigkeit beteiligt sind. Die Gene, die diese 20 verschiedenen Proteine codieren, wurden als „Polyamin-Modulon“ bezeichnet.
Das „Polyamin-MODULON“ ist so eine Reihe von Genen, deren Expression durch Polyamine auf der Ebene der Translation verstärkt wird.
Polyamine liegen hauptsächlich als RNA-Polyamin-Komplex vor.
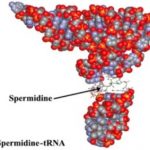
Abb. tRNA im kugelfüllenden Modell mit Spermidin-Bindungsstellen
Polyamine, wie Spermidin, stimulieren den Aufbau von 30S-ribosomalen Untereinheiten und erhöhen dadurch die allgemeine Proteinsynthese um das 1,5- bis 2,0-fache.
Das Spleißen von Transfer-RNA-Vorläufer erfolgt in zwei unterschiedlichen Stadien: endonukleolytische Spaltung, gefolgt von Ligation. Das Ausmaß als auch die Genauigkeit der Spaltung werden durch das Vorhandensein von Spermidin verbessert.
Spermidin ist Vorläufer von Hyposin für die Initiation der Proteinsynthese durch Translation von mRNAs
Hypusin ist eine außergewöhnliche Aminosäure, die in der Natur ausschließlich gebunden an den Initiationsfaktor 5A (eIF5A) vorkommt.
Der Translationsinitiationsfaktor 5A (eIF5A) ist während der gesamten eukaryotischen Evolution hoch konserviert und spielt eine Rolle bei der mRNA-Translation, der Zellproliferation, der Zelldifferenzierung und der Entzündung.
Der Initiationsfaktor 5A (eIF-5A) ist für die eukaryotische Translation bei Ribosomenbindung und bei der Aktivität des Translationsdehnungsfaktors und Aktivität des Translationsinitiationsfaktors wichtig.
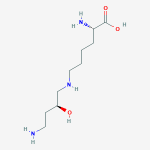
Abb. Hypusin – (2S) -2-Amino-6 – {[(2S) -4-Amino-2-hydroxybutyl] amino} hexansäure
Die Biosynthese von Hypusin ist eine zweistufige Reaktion, an der die Enzyme Desoxyhypusinsynthase (DHPS) und Desoxyhypusinhydroxylase (DOHH) beteiligt sind.
Hypusin wird posttranslational aus Lysin gebildet und befindet sich in einem einzelnen zellulären Protein, dem eukaryotischen Translationsinitiationsfaktor 5A (eIF-5A) und seinem Homologen eIF5A2.
Spermidin ist der Vorläufer von Hypusin, das für die posttranslationale Modifikation des Elongationsfaktors eIF-5A benötigt wird und dessen Mangel die Proteinfunktion beeinflusst.
Spermidin fungiert als Aminobutylgruppendonor für die posttranslationale Modifikation eines spezifischen Lysinrestes des Translationsfaktors eIF-5A durch Desoxyhypusinsynthase.
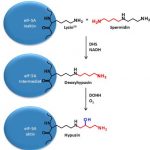
Abb. Schematische Darstellung der zweistufigen Hypusin-Modifikation von eIF-5A.
eIF-5A kann zur Transkription, zum mRNA-Umsatz, zum nukleozytoplasmatischen Transport und zur Apoptose beitragen.
Seine am besten verstandene Funktion besteht jedoch darin, die Translation von mRNAs zu ermöglichen, die für Proteine kodieren, die Polyprolintrakte oder Tripletts von PP X enthalten, wobei X: Glycin, Tryptophan, Asparaginsäure oder Asparagin sein kann.
Ribosomen bleiben auf solchen entstehenden Polyprolinstrecken stehen. Das Ribosomen-gebundene hypusinylierte eIF-5A erreicht das Peptidyltransferase-Zentrum des Ribosoms und stabilisiert und orientiert das CCA-Ende der Peptidyl- tRNA, um die Synthese durch diese Regionen zu ermöglichen.
https://de.wikipedia.org/wiki/TRNA
Referenzen auf Anfrage erhältlich.
Ihr
Eduard Rappold
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
Sojapulver mit
SPERMIDIN und high quality SOJAPROTEIN
Spermidin erhöht die allgemeine Proteinsynthese um das 1,5- bis 2,0-fache
und
Sojaprotein sichert den Erhalt der Muskelmasse und Muskelkraft und hilft den altersbedingten Abbau der Skelettmuskulatur zu verhindern

40 Portionen
mit
mehr als 1,7mg SPERMIDIN und
mehr als 40 Gramm high quality Sojaprotein
pro Messlöffel
www.spermidine-soyup.com
mit online-shop
