Die Mitochondrien-Qualität und -Quantität limitieren die Zellgesundheit – Ademetionin (S-Adenosyl-L-Methionin) schützt unsere Mitochondrien Teil I
Die Mitochondrien-Qualität und -Quantität limitieren die Zellgesundheit –
Ademetionin (S-Adenosyl-L-Methionin) schützt unsere Mitochondrien
in zwei Teilen
Teil I
Übersicht:
Zellgesundheit ist unser höchstes körperliches Gut. Es bedeutet, dass ein Zustand der Jugend für die Zelle und für den gesamten Organismus möglichst lange erhalten bleibt. Zelluläre Vitalität, eine gute Gesundheit und Langlebigkeit des Organismus sind damit unmittelbar verbunden.
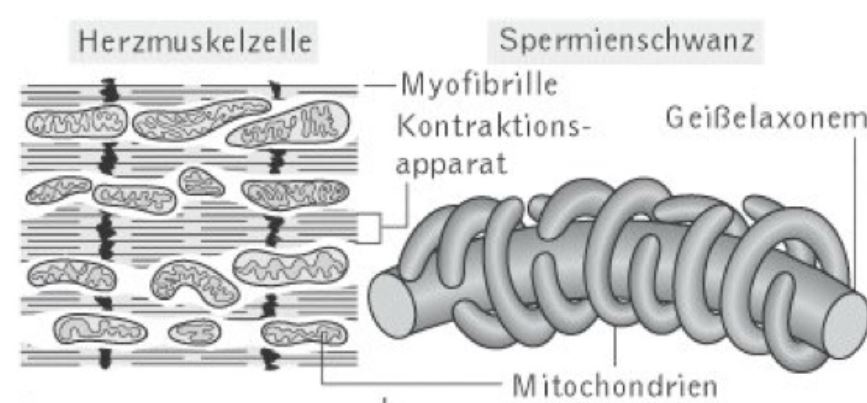
Ein Erwachsener besteht aus 1014 oder 100 Billionen oder 100 000 000 000 000 einzelnen Zellen. In jeder dieser Zellen, mit Ausnahme der Erythrozyten, finden sich mehrere hundert Mitochondrien, in jeder Gehirnzelle sind es sogar bis zu 1000 Mitochondrien und in der sehr stoffwechselaktiven Leberzelle sind bis zu 5000 Mitochondrien enthalten.
Mitochondrien sind mehrdimensionale Organellen, deren Aktivitäten für die zelluläre Vitalität und die Langlebigkeit des Organismus wesentlich sind. „Sind unsere Mitochondrien gesund, sind auch wir gesund“.
Dem stehen entgegen: „Growing old: the most common mitochondrial disease of all?“ und der vom Alter abhängige S-Adenosyl-L-Methionin-Mangel (Ademetionin-Mangel) und die vom S-Adenosyl-L-Methionin abhängige Biosynthese von Spermidin mit konsekutivem Spermidin-Mangel.
Weil bei Spermidinmangel die Autophagie an Effizienz verliert, kommt es zu krankheitsrelevanten Ablagerungen in den Zellen, die wiederum zu Demenz, Diabetes mellitus Typ II, Tumoren und Atherosklerose führen können.
Außerdem: die vermehrte oxidative Stressbelastung (ROS- und RNS) der Zellen bei S-Adenosyl-L-Methionin- (Ademetionin)-Mangel hat ihren Ursprung im ersten Schritt des biochemischen Abbaus von Aminosäuren, der oxidativen Desaminierung, die durch überschießende Monoamin-Oxidasen (MAO)-Expression verursacht wird. Es entstehen zudem durch intermolekulare Quervernetzungen benachbarter Proteine hochmolekulare Aggregate, die nicht mehr durch das Proteasom durch Proteolyse abgebaut werden können und sich in der Zelle anreichern und dadurch deren Funktionalität beeinträchtigen.*
Die Akkumulation dieser Zellschäden begünstigt die Entstehung zahlreicher Erkrankungen, wie beispielsweise Arteriosklerose, Diabetes mellitus Typ II, Krebs, Trübungen der Augenlinse, Rheuma, Fertilitätsstörungen, Nierenleiden und unterschiedliche Hauterkrankungen durch Störung der Hautbarriere.* Auch den Alterungsprozess sollen die im Laufe des Lebens akkumulierenden oxidativen Schäden wesentlich mit bedingen.**
So existiert eine enge Assoziation zwischen erhöhten ROS- und RNS-Spiegeln und dem Auftreten neurodegenerativer Erkrankungen wie Morbus Parkinson, Morbus Alzheimer und der amyotrophischen Lateralsklerose. * Dabei wird die besondere Vulnerabilität des Nervengewebes gegenüber oxidativem Stress zum einen durch die unzureichende Fähigkeit der Neurone zur Regeneration und zum anderen durch deren hohe Stoffwechselaktivität und die damit verbundene erhöhte endogene ROS-Produktion erklärt.***
Auch Schlaganfall und Epilepsie* können mit der erhöhten endogenen ROS-Produktion in Zusammenhang stehen. Zudem liefern Untersuchungen in den letzten Jahren auch Hinweise für eine Fehlfunktion der Mitochondrien bei psychiatrischen Erkrankungen, wie z.B. Bipolarer Störung und Depression.**
Wenn einem diese Zusammenhänge klar sind und man auch bereits ist, rechtzeitig diese vom Alter abhängigen Substratmangelzustände durch Ademetionin- (S-Adenosyl-L-methionin)- und Spermidin-Zufuhr auszugleichen, kann die Vielzahl der sonst daraus resultierenden Krankheiten, die eine Jahrzehnte andauernde Latenzphase bis zum Vollbild der Erkrankung haben, vermieden werden.
Endosymbiontentheorie
LECA und Mitochondrien
Mitochondrien entstanden vor 1,5 Milliarden Jahren durch endosymbiotische Aufnahme von Cyanobakterien durch eukaryotische, mitochondrienhaltige Einzeller (Endobiose). Die meisten neueren Untersuchungen deuten drauf hin, dass die erste eukaryotische Zelle (last eukaryotic common ancestor LECA) durch die Aufnahme eines α-Proteobakteriums durch ein Archaeum, vermutlich aus der Asgard-Gruppe*** entstanden ist. Es war die Schlüsselinnovation auf dem Weg zum multizellulären Leben.
Eine weitere Stütze dieser Entstehungshypothese der Eukaryoten bilden die sogenannten Hydrogenosomen, ATP-bildende Organellen, die in anaerob lebenden Protisten und anderen niederen, in sauerstofffreiem Milieu existierenden Lebewesen vorkommen. Ihre Homologie mit Mitochondrien hat man erst durch Genomanalysen festgestellt. Die meisten Hydrogenosomen enthalten zwar keine DNA, aber in den Kernen der zugehörigen Organismen konnte man Mitochondriengene nachweisen. Anders als bei Mitochondrien dienen bei Hydrogenosomen zur ATP-Bildung nicht Sauerstoffmoleküle sondern Wasserstoffionen (Protonen) als Elektronenakzeptoren. Dabei wird CO2, H2 und Acetat freigesetzt.
Für beide Vorstellungen, Hydrogenosomen haben sich durch Reduktion aus aeroben Mitochondrien entwickelt bzw. die Mitochondrien haben sich aus Hydrogenosomen entwickelt, gilt, dass im Laufe der Endosymbiose immer mehr Gene aus dem α-Protobakterium in das Wirtszellengenom übertragen wurden. So entstand schließlich das Mitochondrium, ein Zellorganell, das nur noch wenige eigene Gene – bei menschlichen Mitochondrien 37 * – und einen stark reduzierten Proteinsynthese-Apparat besitzt. Die meisten Mitochondrien-Proteine werden im Cytosol produziert und über spezielle Membranproteine in die Mitochondrien transportiert.
Abb. Schematische Darstellung der Endosymbiontentheorie (schwarz: Zell- oder Organellmembran; rosa: eukaryotische DNA; grün: cyanobakterielle DNA; rot: proteobakterielle oder mitochondriale DNA)
https://de.wikipedia.org/wiki/Endosymbiontentheorie
Aufbau des Mitochondrium
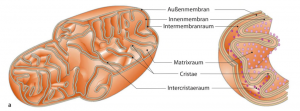
Mitochondrien bestehen wie ihre bakteriellen Vorfahren aus zwei getrennten und funktionell unterschiedlich, einer äußeren (Outer Mitochondiale Membran), die eukaryotische Charakteristika zeigt und einer inneren Membran (Outer Mitochondiale Membran), die den prokaryotischen Ursprung der Doppelmembran darstellt. Beide gemeinsam umschließen den Intermembranraum und die Mitochondrienmatrix ein.
In der Mitochondrienmatrix sind die Enzyme des Tricarbonsäurezyklus (TCA, auch Zitronensäurezyklus oder Krebszyklus genannt) lokalisiert. Es ist der zentrale Stoffwechselweg. Seine Hauptfunktion ist die Oxidation von Acetyl-CoA, einem wichtigen Signalmolekül, aus Kohlenhydraten, Aminosäuren und Fettsäuren. Das TCA ist in einem supramolekularen Komplex organisiert, der mit Mitochondrienmembranen und der Elektronentransportkette interagiert. Aus diesem Grund bieten die meisten TCA-Enzyme zusätzliche Funktionen für die Stabilisierung der mitochondrialen DNA (mtDNA) oder für die Verknüpfung mit der Translation der mitochondrialen RNA (mtRNA), oxidativem Stress, Eisenstoffwechsel und der Tumorsuppression.*
Mitochondrien chatten mit endoplasmatischem Retikulum und mit Lysosomen
Am und im endoplasmatischen Retikulum finden Translation, Proteinfaltung, Proteinqualitätskontrolle, posttranslationale Modifikationen von Proteinen und Proteintransport von Transmembranproteinen und sekretorischen Proteinen (Exozytose) statt.
Die mitochondriale Außenmembran kann sich mit der des Endoplasmatischen Retikulum zusammenschließen und bildet dann eine Struktur, die sich MAM (englisch mitochondria-associated ER-membrane) nennt. Diese ist wichtig für Signalaustausch zwischen Endoplasmatischen Retikulum und Mitochondrium und spielt auch eine Rolle beim Lipidtransfer.
Auch Lysosomen, die zelleigenes Material verdauen (Autophagie) , regulieren über ein Protein (NFYB-1) die Mitochondrienfunktion und die Langlebigkeit. So wird die Signalübertragung von Lysosom zu Mitochondrien über Lipidpools koordiniert, um die zelluläre Mitochondrienfunktion und die Gesundheit des Organismus zu verbessern.*
Monoamin-Oxidasen (MAOs)
Die biologische Rolle der sehr heterogenen Gruppe der Amin-Oxidasen liegt primär in dem oxidativen Abbau von biogenen Aminen, wie aminergen Neurotransmittern.
Neurotransmitter sind biochemische Stoffe, die Informationen von einer Nervenzelle zur anderen über Synapsen weitergeben. Glutamat ist der wichtigste erregende Neurotransmitter im zentralen Nervensystem (ZNS), die wichtigsten hemmenden Neurotransmitter sind GABA (γ-Aminobuttersäure) im ZNS und Glycin im peripheren Nervensystem (PNS).
Weitere wichtige zum Großteil aminerge Neurotransmitter sind z.B. Noradrenalin, Acetylcholin, Dopamin und Serotonin.
Monoaminoxidasen (MAOs) wurden von Mary L.C. Hare (später Mary Bernheim) vor fast einem Jahrhundert, im Jahr 1928 erforscht. Die Entdeckung des ersten MAO, ursprünglich Tyraminoxidase genannt, hat den Forschern den Weg geebnet, das Potenzial von MAOs als biologische Angriffspunkte und die Entwicklung von Therapeutika zu untersuchen, die hauptsächlich mit neurologischen Erkrankungen zusammenhingen****.
Je mehr MAOs produziert werden, um so schneller kann ein Defizit an Monoaminen (Noradrenalin, Acetylcholin, Dopamin und Serotonin) entstehen.****
Es existieren zwei funktionelle Isoformen: MAOA und MAOB
Obwohl die Proteinsequenzen zu ca. 73% identisch sind, weisen sie jedoch regionale Unterschiede in der Enzymaktivität, Substratspezifität und -verteilung im menschlichen Gehirn und in der Peripherie auf*** und beide MAOs sind für die Inaktivierung monaminerger Neurotransmitter wichtig,
Meist befindet sich nur eine Unterform in einem speziellen Organ oder in einem
Zelltyp. Dort haben sie die Aufgabe neben der Regulation der Neurotransmitter
auch am Abbau anderer biogener Amine, wie z.B. Tyramin mitzuwirken.
Im Gehirn regeln die MAOs die Höhe der Substratspiegel der drei Substrate Serotonin, Noradrenalin und Dopamin und nehmen dadurch eine wichtige Stellung in der Modifikation der Signaltransduktion der Synapsen ein.*
Monoamin-Oxidasen A und B sind Oxidoreduktasen
Die Monoamin-Oxidasen A und B sind Oxidoreduktasen. Oxidoreduktasen sind Enzyme, die Redoxreaktionen katalysieren. Es wird bei jeder Reduktion auch gleichzeitig eine Oxidation ausgeführt, zudem sind die Reaktionen umkehrbar und das Reaktionsgleichgewicht liegt oft in der Mitte.
Die Monoamin-Oxidase ist ein Flavin-Adenin-Dinukleotid (FAD) abhängiges Enzym, man spricht auch von der Flavinylierung von Monoamin-Oxidase B, die hauptsächlich an der äußeren Membran der Mitochondrien von Nerven-, Glia- und auch andern Zellen verankert ist, in geringeren Mengen jedoch auch frei im Cytosol sich befindet.**
Oxidative Desaminierung, der erste Schritt des biochemischen Abbaus von Aminosäure
Bei der oxidativen Desaminierung, dem ersten Schritt des biochemischen Abbaus von Aminosäuren, von biogenen und diätetischen Aminen, die durch die MAO-Enzyme katalysiert werden, werden Amine enzymatisch in die entsprechenden Imine umgewandelt, die das aktive Zentrum von MAO verlassen und nicht enzymatisch zu Aldehyden hydrolysiert werden.***
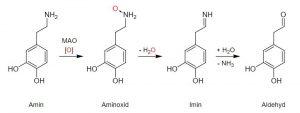
Abb. Oxidation eines primären Amins zum Aldehyd durch die Monoamin-Oxidase am Beispiel des Dopamins
Spezifitäten der MAOs bei der oxidativen Desaminierung von Monoamin-Neurotransmittern
Dopamin, Adrenalin, Noradrenalin, Tryptamin und Tyramin sind Substrate für beide MAO-Isoformen.
Daher spielen MAOs eine wichtige Rolle im zentralen und peripheren Nervensystem (ZNS und PNS), indem sie die Spiegel der Monoamin-Neurotransmitter modulieren.*
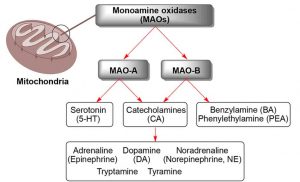
Abb. Spezifitäten der MAOs bei der oxidativen Desaminierung von Monoamin-Neurotransmittern.**
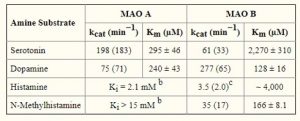
Abb. Umsatzzahlen für die Oxidation von natürlich vorkommenden Amin-Neurotransmittern durch gereinigtes menschliches MAOA und MAOB*
Was ist eigentlich MAOA (Monoamin-Oxydase A)?
Monoamin-Oxidase A (MAO A) ist das Schlüsselenzym, das den Abbau von Serotonin (5-Hydroxytryptamin; 5-HT) und Noradrenalin katalysiert,
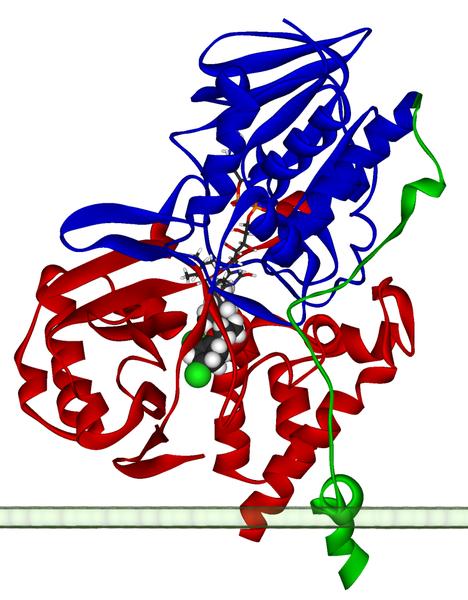
Quelle: De Colibus L, Li M, Binda C, Lustig A, Edmondson DE, Mattevi A (September 2005). „Three-dimensional structure of human monoamine oxidase A (MAO A): relation to the structures of rat MAO A and human MAO B“. Proc. Natl. Ac ad. Sci. U.S.A. 102 (36): 12684–9.
Shih JC, T.R., Monoamine oxidase in neuropsychiatry and behavior. Am J Hum Genet., 1999 Sep. 65(3): S.593-8.
Es gibt Hinweise darauf, dass die MAO A auf genetischer Ebene zu schnell
expremiert wird und damit eine Überaktivität entsteht und infolge ein zu starker Verlust
der monaminergen Neurotransmitter durch verstärkten Abbau droht.
In der Promotorregion des MAO A Gens findet sich ein Tandem-Repeat (Tandem – Wiederholungen treten in der DNA auf, wenn ein Muster aus einem oder mehreren Nukleotiden wiederholt wird und die Wiederholungen direkt nebeneinander liegen), so dass das Gen 3 bis 4 mal schneller abgelesen werden kann, als in der kurzen Form des Promotors.**
DARs mediate the role of monoamine oxidase A in pathological aggression Marco Bortolato, Sean C. Godar, Miriam Melis, Alessio Soggiu, Paola Roncada, Angelo Casu, Giovanna Flore, Kevin Chen, Roberto Frau, Andrea Urbani, M. Paola Castelli, Paola Devoto, Jean C.Shih. J Neurosci. 2012 Jun 20; 32 (25): 8574–8582.
Assoziation einer MAOA-Allelvariante mit geringer Aktivität bei Mixed Martial Arts „Freefight“, in der Sportgenetik und bei Gewaltverbrechen
Erbgang: X-chromosomal-rezessiv
Lippi et al. 2009. Genetics and sports British Medical Bulletin, 1-21
Stetler DA, Davis C, Leavitt K, et al. Association of low-activity MAOA allelic variants with violent crime in incarcerated offenders. J Psychiatr Res. 2014;58:69-75.
Menschen mit funktionellem Polymorphismus der Promotorregion im Monoamin-Oxidase A-Gen (MAOA) neigen dazu, Risiken zu bevorzugen (abgeneigt), wenn sie mit langfristigen Risiken konfrontiert sind, die mit erheblichen Gewinnen (Verlusten) verbunden sind. Probanden mit dem Allel mit hoher Aktivität (4 Wiederholungen) sind durch eine Präferenz für die Longshot-Lotterie (Risikobereitschaft bei verzerrten Glücksspielen) und auch durch weniger Versicherungskauf gekennzeichnet als Probanden mit dem Allel mit niedriger Aktivität (3 Wiederholungen).
Zhong S, Israel S, Xue H, Ebstein RP, Chew SH. Monoamine oxidase A gene (MAOA) associated with attitude towards longshot risks. PLoS One. 2009 Dec 31;4(12):e8516.
MAOA-Mangel nimmt eine wichtige Rolle im Pathomechanismus der Depression ein
Monoaminoxidase Typ A (MAOA) katabolisiert Monoamintransmitter, Serotonin, Noradrenalin und Dopamin. Bei depressiven Störungen werden eine Erhöhung der MAOA-Expression und eine Verringerung der Serotonin- und Noradrenalinspiegel im Gehirn als die wichtigsten pathogenen Faktoren vorgeschlagen. Der funktionelle Polymorphismus des MAOA-Gens und der Gene im Serotonin-Signalweg ist mit Depressionen verbunden.
MAOA und Serotonin regulieren die pränatale Entwicklung und postnatale Aufrechterhaltung der Gehirnarchitektur und des neuronalen Netzwerkes.
Eine beeinträchtigte Neurogenese im reifen Hippocampus wurde als „adulte Neurogenese“ -Hypothese einer Depression vorgeschlagen.
Konzeptualisierungen der zugrunde liegenden Neurobiologie der Major Depression haben ihren Fokus von Störungen der Neurotransmission auf Störungen der Neurogenese und Neuroprotektion verlagert.
MAOA moduliert die Empfindlichkeit gegenüber Stress in den Stadien der Entwicklung und Reifung des Gehirns, und die Interaktion von Gen-Umwelt-Faktoren im frühen Stadium reguliert den Beginn depressiver Verhaltensweisen im Erwachsenenalter. Umgekehrt beeinflussen Umweltfaktoren die MAOA-Expression durch epigenetische Regulation.
Naoi M, Maruyama W, Shamoto-Nagai M. Type A monoamine oxidase and serotonin are coordinately involved in depressive disorders: from neurotransmitter imbalance to impaired neurogenesis. J Neural Transm (Vienna). 2018 Jan;125(1):53-66.
Kersting A, K.K., Horstmann J, Baune BT, Hohoff C, Mortensen LS,
Neumann LC, Arolt V, Domschke K., Association of MAO-A Variant with
Complicated Grief in Major Depression. Neuropsychobiology., 2008 mar.
Meyer JH, G.N., Boovariwala A, Sagrati S, Hussey D, Garcia A, Young T,
Praschak-Rieder N, Wilson AA, Houle S., Elevated monoamine oxidase a
levels in the brain: an explanation for the monoamine imbalance of major
depression. 2006 Nov. Arch Gen Psychiatry.
Die Erhöhung der Aktivität der MAO A wird für den starken Verlust von Monoaminen im Gehirn
von Depressiven mitverantwortlich gemacht.
Meyer JH, G.N., Boovariwala A, Sagrati S, Hussey D, Garcia A, Young T,
Praschak-Rieder N, Wilson AA, Houle S., Elevated monoamine oxidase a
levels in the brain: an explanation for the monoamine imbalance of major
depression. 2006 Nov. Arch Gen Psychiatry.
Nicole Schilling, Aktivität der Enzyme Monoamin-Oxidase A und Monoamin-Oxidase B im Serum
depressiver Patienten. 2013
Zwischen Polymorphismen und der Depression findet man starke
Zusammenhänge.*
Stressbedingte vorzeitige Seneszenz durch MAOA
Eine Studie zeigt, dass MAO-A -SIPS- stress‐induced premature senescence – in Herzzellen durch ROS-Produktion, mitochondriale Dysfunktion und Parkin-vermittelte Mitophagie-Hemmung steuern kann.
Die zelluläre Seneszenz, der in somatischen Zellen beobachtete irreversible Zellzyklusstillstand, ist ein wichtiger Treiber für altersassoziierte Krankheiten. Mitochondrien sind in den Seneszenzprozess verwickelt, hauptsächlich, weil sie sowohl Quellen als auch Ziele von reaktiven Sauerstoffspezies (ROS) sind.
Das mitochondriale Enzym Monoamin-Oxidase-A (MAOA) ist eine relevante Quelle für ROS im Herzen durch die Bildung von H2O2, das aus dem Abbau seiner Hauptsubstrate Noradrenalin und Serotonin stammt.
Manzella N et al. Monoamine oxidase-A is a novel driver of stress-induced premature senescence through inhibition of parkin-mediated mitophagy. Aging Cell. 2018 Oct;17(5): e12811.
Panikstörung durch Serotonin-Mangel bei erhöhter Monoamin-Oxidase A-Expression
Die Freiburger Psychiaterin Katharina Domschke untersuchte Menschen mit einer Panikstörung und fand heraus, dass das Enzym Monoamin-Oxidase A (MAOA) aufgrund einer veränderten Epigenetik vermehrt produziert wird. Die Monoaminoxidase A baut das als „Wohlfühlhormon“ bekannte Serotonin ab, das bei der Panikstörung oft nur in geringer Menge vorhanden ist. In einem Folgeversuch beobachtete sie, dass die Patienten, die auf eine Psychotherapie ansprachen, sich epigenetisch den gesunden Teilnehmern anglichen.
Epigenetic profiling of anxiety: the role of DNA methylation in the pathogenesis and therapeutic mechanisms of anxiety disorders (SFBTRR-58, project C02, 2nd funding period 2013-2016; together with Prof. Dr. K.P. Lesch, Prof. Dr. J. Deckert)
Anxiety and emotional perception – Modulation by the adenosine, dopamine and endocannabinoid system (SFBTRR-58, project C02, 1st funding period 2008-2012; together with Prof. Dr. J. Deckert)
Was ist eigentlich MAOB (Monoamin-Oxydase B)?
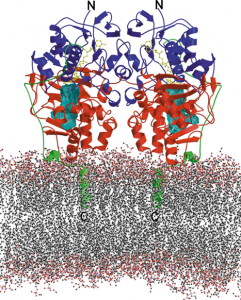
Abb. Dreidimensionale Struktur von humaner Mao B, die an die Phospholipiddoppelschicht der äußeren mitochondralen Membran gebunden ist.
ClaudiaBinda et al. Crystal structure of human monoamine oxidase B, a drug target enzyme monotopically inserted into the mitochondrial outer membrane. FEBS Lett. 2004 Apr 30;564(3):225-8.
Die MAO B hat eine Spezifität zu 2-phenylethylamin und Benzylamin.
Im menschlichen Gehirn sind etwa 75% des MAO vom B-Subtyp (Saura Marti et al., 1990).
Die MAO-B Aktivität ist am stärksten in absteigender Reihenfolge: in Basalganglien, Thalamus, Frontallappen, Cerebellum und Parietallappen und MAOB wird hauptsächlich in serotonergen Neuronen und Glia exprimiert.**
Dopamin wird hauptsächlich durch MAO-B in Substantia Nigra metabolisiert, wobei MAO-B die in Gliazellen am häufigsten verteilte Isoform ist und die erhöhte MAO-B-Aktivität mit dem Verlust von Dopamin im menschlichen Gehirn verbunden ist.**
Glucocorticoide induzieren die MAO B Expression
Glucocorticoide induzieren die MAO B Expression. Die konsekutive oxidative Desaminierung beim Abbau des Neurotransmitters Dopamin führt durch die Freisetzung von neuro- und gliazytotoxischen Abbauprodukten zum Zelltod der Neurone und zum Tod der Makrogliazellen.
Die akute Exposition gegenüber niedrigen oder hohen Glukokortikoidspiegeln von kultivierten Neuronen in Skelettmuskelzellen und Hippocampusneuronen erhöhte die mitochondriale Aktivität. Eine längere Exposition gegenüber Glukokortikoiden führt jedoch zu Funktionsstörungen der Atmungskette, erhöhter ROS-Bildung, mitochondrialen Strukturanomalien, Apoptose und Zelltod.
Stress erhöht die Spiegel entzündungsfördernder Zytokine wie Interleukin (IL) -1β, IL-6 und Tumornekrosefaktor-α, die die mitochondriale Aktivität unterdrücken und mitochondriale Schäden verursachen.
Adrian L. Lopresti, Mitochondrial Dysfunction and Oxidative Stress: Relevance to the Pathophysiology and Treatment of Depression. in Neurobiology of Depression, 2019
Die MAO B kann bei erhöhtem Vorkommen die Apoptose (Zelltod) von Nerven- und
Nierenzellen induzieren.
Boulton AA, E.G., Catecholamine metabolism. From molecular
understanding to clinical diagnosis and treatment. Overview. Adv
Pharmacol. , 1998. 42:S. 273-92.
Vindis, C., et al., Monoamine Oxidase B Induces ERK-Dependent Cell
Mitogenesis by Hydrogen Peroxide Generation. Biochemical and
Biophysical Research Communications, 2000. 271(1): S. 181-185.
Außerdem konnte man eine erhöhte Aktivität der
MAO B in Astrozyten im Gehirn von an Alzheimer erkrankten Patienten
nachweisen werden.
Saura, J., et al., Increased monoamine oxidase b activity in plaqueassociated astrocytes of Alzheimer brains revealed by quantitative
enzyme radioautography. Neuroscience, 1994. 62(1): S. 15-30.
Zigarettenrauchen hat einen Einfluss auf die Aktivität der Monoamin-Oxidase B (MAOB)
Bereits 1981 wurde von Oreland et al. festgestellt, dass Zigarettenrauchen einen Einfluss auf die Aktivität der Monoamin-Oxidase B (MAOB) hat,
Oreland L, F.C., Schalling D., Low platelet monoamine oxidase activity in
cigarette smokers. Life Sci., 1981. 29(24): S. 2511-2518.
was mehrfach bestätigt wurde.
Berlin, I.S., S.; Spreux-Varoquaux,O.; Olivares,R.; Launay,JM.; Puech,
AJ., Monoamine oxidase A and B activities in heavy smokers. Biol
Psychiatry., 1995. 38(11): S. 756-761.
Fowler, J., et al., Monoamine Oxidase and Cigarette Smoking.
NeuroToxicology, 2003. 24(1): S. 75-82.
Zytoxizität bei erhöhter Monamino-Oxidase- Expression
Die erhöhte MaoB steht im Zentrum der Pathogenese der Neurodegeneration im ZNS durch das Vorkommen der MaoB an der äußeren Mitochondrienmembran.
Erhöhte MAOB-Werte finden sich:
im Alter (die MAOB ist um das 4 bis 5-fache erhöht),
bei LOAD (late-onset Alzheimer’s disease),
glucocorticoidinduziert bei toxischem Stress und bei Burnout,
bei Depressionen,
bei Traumata,
bei Rauchern und Passivrauchern,
bei Dauereinnahme von Protonenpumpen-Inhibitoren und
bei Leberzellschaden
Durch die Generierung von oxidativen Zellstress (ROS und RNS), begleitet von mitochondrialer Dysfunktion, kommt es infolge zum Verlust an Neuronen und Astrozyten im ZNS (Neurodegeneration).
Überexpression von MAO-B verstärkt die Prozessierung der Alzheimer Krankheit
Die fibrilläre Form der γ-Sekretase ist der Hauptbestandteil der Amyloid-Plaques im Gehirn von Alzheimer- Patienten.
Nichtamyloidogene und amyloidogene Wege der APP-Verarbeitung von APP
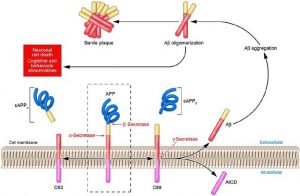
Abb. Die nichtamyloidogenen und amyloidogenen Wege der APP-Verarbeitung von APP werden entweder durch Alpha- oder Beta-Sekretase gespalten. Die Spaltung durch Alpha-Sekretase (der nicht-amyloidogene Weg) erzeugt sAPP-alpha und C83 (links). Die Spaltung durch Beta-Sekretase (der amyloidogene Weg) erzeugt sAPP-beta und C99 (rechts). C83 wird durch Gamma-Sekretase gespalten, wodurch AICD und p3 (nicht gezeigt) erzeugt werden. C99 wird auch durch Gamma-Sekretase gespalten, wodurch AICD und Abeta erzeugt werden (rechts).
Spies PE, Verbeek MM, van Groen T, Claassen JA. Reviewing reasons for the decreased CSF Abeta42 concentration in Alzheimer disease. Front Biosci (Landmark Ed). 2012 Jun 1;17:2024-34.
MAO-B hat einen regulatorischen Effekt auf die intraneuronalen Aβ-Spiegel, der durch γ-Sekretase vermittelt wird.
Die Überexpression von MAO-B verstärkt die Prozessierung des unmittelbaren Substrats für γ-Sekretase (C99), was zu einer erhöhten Aβ-Bildung führte. Darüber hinaus besteht eine Korrelation zwischen MAO-B- und Aβ42-Spiegeln in kortikalen Neuronen und die Stummschaltung von MAO-B in diesen Neuronen verringert die intrazellulären Spiegel von Aβ42.
Schedin-Weiss S. et al. Monoamine oxidase B is elevated in Alzheimer disease neurons, is associated with γ-secretase and regulates neuronal amyloid β-peptide levels. Alzheimers Res. Ther. 2017; 9: 57.
Zellner M, Baureder M, Rappold E, Bugert P, Kotzailias N, Babeluk R, Baumgartner R, Attems J, Gerner C, Jellinger K, Roth E, Oehler R, Umlauf E. Comparative platelet proteome analysis reveals an increase of monoamine oxidase-B protein expression in Alzheimer’s disease but not in non-demented Parkinson’s disease patients. J Proteomics. 2012 Apr 3;75(7):2080-92.
Es wird angenommen, dass die γ-Sekretase sich vorwiegend im Golgi-Apparat, einem membranumschlossenen Reaktionsraum innerhalb der Zelle, dem endoplasmatischen Retikulum, der Plasmamembran, den Endosomen und Lysosomen, also an jenen Orten an denen auch die MAOs lokalisiert sind, sich befindet.
Wenn mitochondriales MAO-B mit γ-Sekretase interagiert, findet die Interaktion wahrscheinlich an der Mitochondrien-assoziierten endoplasmatischen Retikulum-Membran (MAM englisch mitochondria-associated ER-membrane) statt, da vermutet wird, dass die γ-Sekretase im endoplasmatischem Retikulum-Teil des MAM angereichert ist.****
Zytotoxische (neurotoxische und astrogliatoxische) Monamine-Abbauprodukte
„Die Genexpression ändert sich ständig“. Alter und Lifestyle beeinflussen die Zellgesundheit.
Schon um das 35.Lebensjahr kommt es zu einer merklichen Abnahme der S-Adenosylmethionin-Produktion in den Leberzellen und als Folge der Hypomethylierung der Genorte der Monaminoxidasen A und B kommt es zu erhöhter MAOA- und MAOB-Expression mit zytotoxischen Abbauprodukten (ROS und NOS) aus der oxidativen Desaminierung der monaminergen Neurotransmitter, die die Quantität und Qualität der Mitochondrien und die ATP-Produktion störend beeinflussen.
Diese zytotoxischen Abbauprodukte sind als Oxidativer Zell- Stress, als reaktive Stickstoffspezies, Peroxynitrit ONOO− und als reaktive Sauerstoffspezies wie:
- Hyperoxid Anion (O2–)
- Hydroxyl-Radikal (HO·)
- Peroxylradikal (ROO·)
- Alkoxylradikal (RO·)
- Wasserstoffperoxid (H2O2)
- Hydroperoxid (ROOH)
- Ozon (O3)
- Hypochlorit-Anion (OCl−)
- Singulett-Sauerstoff (1O2)
bekannt, die ein Nebenprodukt der Zellatmung sind, aber hauptsächlich durch Monoamin-Oxidasen, wie MAO B beim Abbau von monaminergen Botenstoffen (Neurotransmitter), wie Dopamin, Noradrenalin und Serotonin, entstehen.
Monoamin-Oxidation durch oxidative Desaminierung führt zu oxidativen Zell- Stress (ROS-Belastung, Bildung freier Radikale)
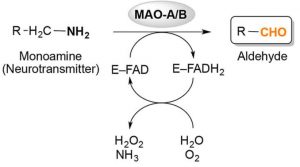
Abb. Oxidative Desaminierung von Monoaminen, katalysiert durch Monoamin-Oxidasen (MAOs) A und B. Das allgemeine Reaktionsschema zeigt, die Bindung eines Monoamins (monaminergen Neurotransmitters) an das Flavoenzym (E-FAD) zum jeweiligen Aldehyd und Ammoniak durch Reduktion des Flavins Adenindinukleotid (FAD) -Cofaktor zu FADH2.
Die bei der oxidativen Desaminierung entstehenden Hydroxylradikale zerfallen innerhalb von Nanosekunden und können Kettenreaktionen mit Bildung freier Radikale in Gang setzen. Das führt in Membran- oder Lipoproteinnähe zum Angriff auf die Fettsäureseitenketten der Phospholipide. Hier werden, indem die freien Radikale mit Lipiden, DNA und Aminosäuren in den Proteinen reagieren, degenerative Prozesse ausgelöst. Dabei bildet sich Wasser und ein Radikal mit zentralem Kohlenstoffatom. Das Radikal reagiert mittels Sauerstoff zum Peroxyradikal weiter. Peroxyradikale sind reaktionsfreudig genug, um die Fettsäureseitenketten anzugreifen, so dass es zur eben genannten Kettenreaktion kommt, die auch als Lipidperoxidation bekannt ist.
Die Generierung von toxischen oxidativen Zellstress durch die Abbauprodukte aus der oxidativen Desaminierung der Monamine bei erhöhter MAOB-Aktivität (MAOB-Expression) und der oxidativen Phosphorylation und der durch mitochondriale Dysfunktion verursachte ATP-Mangel führen zu Mitochondrien- und Gehirnzell-Verlust.
Durch Hypomethylierung der Genorte erhöht sich die MAO B Aktivität (erhöhte Expression der MAO B) im Mitochondrium durch die Lokalisierung der MAOB an der äusseren Mitochondrienmembran und der Anfall von ROS- und RNS-Abbauprodukten aus der oxidativen Desaminierung der monaminergen Gehirnbotenstoffe wirkt zytotoxisch (Neurodegenation, Verlust an Gehirnzellen).
Darüberhinaus führt eine erhöhte MAO B Aktivität zu einer oxidativen Stressantwort am endoplasmatischen Retikulum mit Unterdrückung der Translation mit fehlerhaft gefalteten Proteinen.
Die erhöhte MAO B -Aktivität an der Lysosomenmembran behindert die Autophagie.
Eine Autophagie-Dysfunktion kann zur neuritischen Dystrophie durch Beeinträchtigung der Clearance von autophagischen Vakuolen führt.
Ferroptose ist eine Art von programmiertem Zelltod, die von Eisen abhängt und durch die Anhäufung von Lipidperoxiden gekennzeichnet ist. Sie unterscheidet sich genetisch und biochemisch von anderen Formen des regulierten Zelltods wie der Apoptose.
OXPHOS-Funktionsstörungen bei Erkrankungen mit psychotischen Merkmalen wie Schizophrenie und bipolarer Störung
Dopamin kann von den Mitochondrien aufgenommen werden und eine dosisabhängige Hemmung der Co I (Komplex I)-Aktivität hervorzurufen.
Es wurde gezeigt, dass Co I (Komplex I) im OXPHOS, zur hochenergetischen Phosphatproduktion (ATP-Synthese), sowohl für Dopamin als auch für Antipsychotika ein Interaktionsort ist, was seine Rolle in der Schizophrenie-Pathologie untermauert.
Während der Zellatmung werden Elektronen zuerst von den Zitronensäurezyklusprodukten NADH und Succinat über die Komplexe I (Co I) bzw. II (Co II) auf Ubichinon übertragen. Sie passieren dann Komplex III (Co III) und Cytochrom c und enden bei Komplex IV (Co IV). In diesem Prozess reduziert Co IV O 2 zu H 2 O.
Beeinträchtigungen der Differenzierung und Reifung von Schizophrenie-abgeleiteten induzierten pluripotenten Stammzellen (iPSCs) in dopaminerge und glutamaterge Neuronen sowie eine Verringerung der Co I-gesteuerten Zellatmung konnte gezeigt werden.
Bergman O, Ben-Shachar D. Mitochondrial Oxidative Phosphorylation System (OXPHOS) Deficits in Schizophrenia: Possible Interactions with Cellular Processes. Can J Psychiatry. 2016;61(8):457-469.
Dopamin-Abbau und dopaminerger Neuronenverlust
Ein wichtiger Akteur für den dopaminergen Neuronenverlust, kann der Dopamin-Stoffwechsel selbst sein, der als eine Hauptquelle der intrazellulären ROS Produktion gilt.
Dopamin wird überwiegend durch MaoB oxidativ desaminiert.
Oxidative Desamination durch MaoB produziert Hydrogen-Peroxid und das reaktive 3,4-Dihydroxyphenylacetaldehyd (DOPAL).
Aus dem synaptischen Spalt wird Dopamin auch von umgebenden Gliazellen Zellen aufgenommen. In den glialen Zellen wird Dopamin von MaoB und auch durch die Catechol-o Methyl-Transferase (COMT) abgebaut. COMT überträgt Methyl-Gruppen von S-Adenosyl-L-Methionin (Ademetonin) auf Hydroxyl-Gruppen verschiedener katecholer Verbindungen.
Männistö PT, Ulmanen I, Lundström K, Taskinen J, Tenhunen J, Tilgmann C, Kaakkola S: Characteristics of catechol O-methyl-transferase (COMT) and properties of selective COMT inhibitors. Prog Drug Res. 1992, 39: 291-350.
Dale E. Edmondson et al. Molecular and Mechanistic Properties of the Membrane-Bound Mitochondrial Monoamine Oxidases. Biochemistry. 2009 May 26; 48(20): 4220–4230.
Norrie-Syndrom
Die Monoamin-Oxidasen sind auch bei einem genetischen Syndromkomplex betroffen, dem sogenannten Norrie-Syndrom. Häufig wird bei diesem Syndrom keine MAO A gebildet oder weniger MAO B.
Beim Norrie-Syndrom liegt eine rezessive Genmutation des X-Chromosoms vor, weshalb es nur bei Männern vorkommt.*
Der Weg zur Zellgesundheit
Zellgesundheit ist unser höchstes körperliches Gut. Es bedeutet, dass ein Zustand der Jugend für die Zelle und für den gesamten Organismus möglichst lange erhalten bleibt. Zelluläre Vitalität, eine gute Gesundheit und Langlebigkeit des Organismus sind damit unmittelbar verbunden.
- Eine bedarfsdeckende und altersabhängige Ademetionin-(S-Adenosyl-L-Methionin)-Substitution für die ausreichende Methylierung der DNA und Histone führt zur Reduktion der zytotoxischen MAOA und MAOB-Überexpression
- Eine bedarfsdeckende und altersabhängige Ademetionin-(S-Adenosyl-L-Methionin)-Substitution sichert die Spermidin-Biosynthese durch Aminopropylation im C1-Zyklus.
- Ademetionin-(S-Adenosyl-L-Methionin)-Substitution schützt die Mitochondrien indem weniger ROS -Abbauprodukte aus der oxidativen Desaminierung von Dopamin und anderer monaminerger Neurotransmitter zu Zytotoxizität und Apoptoseinduktion in den Mitochondrien führen.
- Eine bedarfsdeckende und altersabhängige Ademetionin-(S-Adenosyl-L-Methionin)-Substitution sichert die Glutathion-Biosynthese durch Transsulfuration im C1-Zyklus. Glutathion ist das potenteste Antioxidans der Zelle.
- Eine bedarfsdeckende und altersabhängige Ademetionin-(S-Adenosyl-L-Methionin)-Substitution schützt die Zelle vor ER-Stress (ER=Endoplasmatisches Retikulum) und ermöglicht eine reguläre Proteinsynthese.
- Eine bedarfsdeckende und altersabhängige Ademetionin-(S-Adenosyl-L-Methionin)-Substitution induziert die Spermidin-Biosynthese, ermöglicht eine reguläre Membranogenese und fördert die Autophagie, die mittels Autophagosomen nach Fusion mit Lysosomen, fehlgefaltete Proteine, Viren und Bakterien aus der Zelle ausschleust aber auch den zellulären Substrattransport in Vakuolen ermöglicht.
- Zellgesundheit repräsentiert die jugendliche biologische Unschuld der Zelle. Zellgesundheit verzögert die Zellalterung als pathophysiologische Folge, die zu Schäden an den Zellbestandteilen führt, die Krankheiten verursachen.
- Präventive Substitution von Ademetionin-(S-Adenosyl-L-Methionin) und von Spermidin sichert die Zellgesundheit.
Wenn einem diese Zusammenhänge klar sind und man auch bereits ist, rechtzeitig diese vom Alter abhängigen Substratmangelzustände aus zu gleichen, dann kann die Vielzahl der sonst daraus resultierenden Krankheiten, die eine Jahrzehnte andauernde Latenzphase bis zum Vollbild der Erkrankung im Alter haben, vermieden werden.
Mit * bezeichnete Stellen enthalten zusätzliche Literaturangaben.
Ende des 1. Teils
Ihr
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
 EBP® – Epigenetic Brain Protector
EBP® – Epigenetic Brain Protector
enthält 400 mg Ademetionin (S-Adenosyl-L-Methionin) pro Kapsel in der biologisch aktiven (S,S) Form in präventiver Dosierung

NUGENIS Goldmedaille Iena 2015
für hervorragende Leistungen
zum Schutz vor Gehirnzellenuntergang

EBOP® – Epigenetic Burnout Protector
schützt bei toxischem Stress und Burnout
enthält 400 mg Ademetionin-(S-Adenosyl-L-Methionin) pro Kapsel in der biologisch aktiven (S,S) Form in präventiver Dosierung

ECP® – Epigenetic Cartilage Protector
schützt die Gelenksknorpelzellen und die Bandscheiben
enthält 400 mg Ademetionin-(S-Adenosyl-L-Methionin) pro Kapsel in der biologisch aktiven (S,S) Form in präventiver Dosierung
Sojapulver mit SPERMIDIN und high-quality-PROTEIN
www.spermidine-soyup.com
sichert die reguläre Proteinsynthese und induziert die Autophagie
ist ein Kalorienrestriktionsmimetikum und hilft bei Übergewicht

40 Portionen
mit
mehr als 1,7mg SPERMIDIN pro Messlöffel

