AUTOPHAGIE – HINTERGRÜNDE
AUTOPHAGIE – HINTERGRÜNDE
Was ist Autophagie und wofür ist sie wichtig?
Eine vereinfachte Definition der Autophagie ist, dass es sich um einen äußerst komplexen Prozess handelt, der modifizierte, überflüssige (überschüssige) oder beschädigte zelluläre Makromoleküle (Proteine, Nukleinsäuren) und ganze Organellen unter Verwendung von hydrolytischen Enzymen in sackartigen Lysosomen abbaut.
Säugetierzellen können drei Haupttypen von Autophagie durchlaufen:
Makroautophagie, Mikroautophagie und Chaperon-vermittelte Autophagie
Der Vorgang der Autophagie besteht aus aufeinanderfolgenden Schritten: der Induktion der Autophagie, der Bildung des Autophagosomenvorläufers, der Bildung von Autophagosomen, aus der Fusion zwischen Autophagosom und Lysosom, dem Abbau des Ladungsinhalts, dem Effluxtransport abgebauter Produkte zum Zytoplasma und der Lysosomenreformation.
Die autophagische Lysosomenreformation (ALR) ist der Endschritt der Autophagie und für die Aufrechterhaltung der Lysosomenhomöostase während der Autophagie unerlässlich. Während der ALR werden Tubuli aus Autolysosomen extrudiert. Kleine Vesikel, sogenannte Protolysosomen, die sich aus lysosomalen Membrankomponenten zusammensetzen, werden aus diesen Tubuli erzeugt. Schließlich reifen Protolysosomen zu funktionellen Lysosomen heran.
Autophagie ist mehr als ein zytosolisches Ereignis
Während der Autophagie treiben mehrere zytosolische ATG- (autophagiebezogene) und ATG-assoziierte Proteine die Bildung der umschließenden Organelle voran. ATGs (autophagy-related genes) spielen eine Schlüsselrolle bei der Bildung des anfänglichen Membranvesikels oder Membranphagophors und dessen anschließender Verlängerung, die zum Einschluss von Zellbestandteilen führt. Das resultierende Autophagosom fusioniert mit Lysosomen und ermöglicht so den Abbau des Sequestrierungsgehalts.
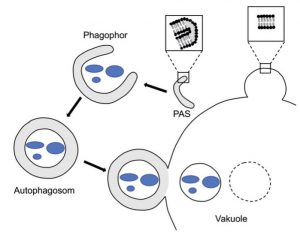
Am PAS (phagophore assembly site) entsteht der hufeisenförmige Phagophor aus einer doppelten Membran, wodurch Autophagie zu einem einzigartigen intrazellulären Transportweg wird. Der Phagophor schließt sich zur Bildung des Autophagosoms, das eine Doppelmembran besitzt. Es wird zur Vakuole (Lysosom) transportiert und fusioniert mit der vakuolären Membran. In der Vakuole befindet sich nun ein Vesikel, das von einer einfachen Membran umgeben ist. Diese wird durch spezielle Enzyme lysiert, und der cytosolische Inhalt der Autophagosomen wird abgebaut.
Referenz:
Roswitha Krick. Molekulare Mechanismen selektiver Autophagie. Göttingen. 2018. DOI: 10.1007/s12268-018-0937-2
„Omnis membrana e membrana“- der Ursprung des Lebens durch eine kompartimentierte Zellbiologie
In Anlehnung an den Aphorismus Virchow´s: „Omnis cellula e cellula“ schrieb 1980 der Biologe Gunter Blobel „Omnis membrana e membrana“ und meinte damit, dass bei Zellen alle zellulären Reaktionen in biologischen membrangebundenen Organellen stattfinden und beleuchtete so das Prinzip der Membranbiogenese ( Blobel, 2000 ) sowie die Herausforderung, die die eukaryontischen Zellen zu meistern haben, nämlich Material effizient zwischen Organellen, einschließlich Ladungen und Membranen, präzise auszutauschen.
Leben ist somit ein System aus sich selbst bildenden Mikrokompartimenten, die imstande sind, nutzbare Energie in Kohlenstoffchemie umzusetzen, sodass mehr ihresgleichen entsteht.
Andererseits ist das Leben eine chemische Reaktion. Bei allen Lebensformen sind es Redoxreaktionen – bei uns Menschen ist das die Verbrennung von Sauerstoff in unseren Mitochondrien, bei anderen Organismen sind es andere chemische Reaktionen, die zum Aufbau der Protonengradienten in der Atmungskette ablaufen.“
Die kompartimentierte Zellbiologie spiegelt das Prinzip wider, nach dem eine eukaryotische Zelle ihre innere Landschaft organisiert. Aufgrund der Kompartimentierung ist der präzise und effiziente Austausch von Material zwischen verschiedenen Kompartimenten das wichtigste Thema, mit dem sich eine Zelle zu befassen hat.

Abb. Günter Blobel erhält 1999 den Nobelpreis
aus den Händen des schwedischen Königs Carl Gustaf, Quelle: dpa
Der Vorteil von unterteilten Zellstrukturen ermöglicht es den Zellen, über einen speziellen Raum zu verfügen, um spezialisierte Reaktionen effizient auszuführen, d.h. den Zellkern für die Speicherung und Übertragung genetischer Informationen, Lysosomen für das Recycling von Material, Mitochondrien für den Energiestoffwechsel, endoplasmatisches Retikulum (ER) und Golgi Apparate zur Proteinsynthese zu haben. Die meisten, wenn nicht alle biologischen Reaktionen finden in membrangebundenen Organellen statt, und Membranen fungieren nicht nur als Barrieren zwischen der Zelle und ihrer äußeren Umgebung, sondern bieten auch eine physikalische Plattform für verschiedene Reaktionen.
Yoshinori Ohsumi – Arbeiten zu Abbau- und Recyclingprozessen in Zellen
Der Japaner Yoshinori Ohsumi *1945 hat 2016 den Medizin-Nobelpreis für seine Arbeit zu Abbau- und Recyclingprozessen in Zellen bekommen.

Abb. Yoshinori Ohsumi, Quelle: Die Welt
Das Wort Autophagie setzt sich aus den griechischen Wörtern auto- (selbst) und phagein (essen) zusammen und bedeutet damit wörtlich „Selbstfressen“.
Was gefährlich klingt, ist lebensnotwendig: Bei dem fortlaufend stattfindenden Prozess werden etwa geschädigte oder funktionslose Proteine oder Zellorganellen verdaut und aus dem Verkehr gezogen. Man kann sich das wie eine Art Müllabfuhr vorstellen, allerdings mit Recyclinganlage (Proteasom). Denn einzelne, noch verwertbare Bestandteile werden wiederverwendet.

Gäbe es keine Autophagie, würden die Müllsäcke unserer Zellen überquellen. Außerdem werden bei dem Prozess nicht nur Proteine oder Zellorganellen herausgefiltert und abgebaut. Es können auf diese Weise auch Eindringlinge wie Viren, Bakterien oder andere Mikroorganismen in der Zelle bekämpft werden. Damit kommt der Autophagie bei Infektionen, in Alterungsprozessen und bei der Entstehung von Tumoren und Krankheiten eine Schlüsselfunktion zu.
Fünfzehn Gene steuern entscheidend die Autophagie-Vorgänge. Denn der Prozess unterliegt einer ständigen Kontrolle, damit weder zu wenig Müll abtransportiert wird, noch gesunde Strukturen fälschlicherweise als Müll identifiziert werden.
Ohsumi hatte die ATG-Gene (autophagy-related genes), die an der Autophagie beteiligt sind in Hefezellen beschrieben.
Referenz:
Tsukada M1, Ohsumi Y. Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae. FEBS Lett. 1993 Oct 25;333(1-2):169-74.
Frank Madeo hat Spermidin als Autophagie-Aktivator erstmals beschrieben

Abb. Joachim F. Scheele, Vorstandsvorsitzender des Industrie-Clubs (l.), überreichte Frank Madeo die Seneca-Medaille 2019 in Düsseldorf.
Foto: Industrie-Club e.V. Düsseldorf.
„Eine bahnbrechende Leistung von Professor Madeo ist die Entdeckung der Anti-Aging-Wirkung von Spermidin als der bis dato einzigen natürlichen Substanz, die durch die Aktivierung des Fastenprozesses das Leben von Säugetieren verlängern kann und demenzprotektive Wirkung hat“, so die Düsseldorfer Seneca-Medaillen Jury.
Univ.-Prof. Dr. rer. nat. Frank Madeo wurde 1967 in Schwerte (Deutschland) geboren und studierte Biologie an der Universität Tübingen. Nach mehrjähriger Tätigkeit als Gruppenleiter in Tübingen wurde er 2004 ans Institut für Molekulare Biowissenschaften der Universität Graz berufen.
Ihr Eduard Rappold
Alles was Sie über Ademetionin wissen sollten
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
www.spermidine-soyup.com

