Das Gehirn und Spermidin
Das Gehirn und Spermidin
Das Gehirn hat den höchsten Gehalt an Spermidin.
Trotz des ubiquitären Vorkommens sind die Polyamine Spermidin und Spermin im Vergleich verschiedener neuronaler und glialer Zelltypen inhomogen verteilt. Es besteht auch eine differentielle Expression der Spermidine in verschiedenen Neuronenpopulationen.
Während Spermidin-Synthase und Spermidin/Spermin in einigen Kerngebieten, wie z.B. den supraoptischen und paraventrikulären hypothalamischen Kernen, gemeinsam auftreten, zeigten sich in anderen Arealen des Gehirns deutliche Unterschiede in der Verteilung. Diese Diskrepanz lässt sich unter der Annahme von Transportprozessen und der daraus resultierenden Umverteilung von Spermidin (Spd) und Spermin(Spm) in die Spd/Spm-positiven Zellen hinreichend erklären.
Diese Annahme einer Umverteilung von Polyaminen wird unterstützt durch die Spermidin-Synthase (SpdS)-Armut stark Spd/Spm-haltiger Astrozyten, die als Polyaminspeicher für neuronal synthetisierte Polyamine in Frage kommen.
Eine hiermit teilweise übereinstimmende, inhomogene Verteilung in Neuronen wurde auch für die Ornithindecarboxylase beschrieben.
Ornithindecarboxylase (ODC) katalysiert die Decarboxylierung von Ornithin zu Putrescin. Die fehlende ODC-Immunreaktivität in Spermidin/Spermin-haltigen Astrozyten wurde als Hinweis auf Synthese- und Transportvorgänge zwischen Neuronen und Gliazellen interpretiert.
Den Astrozyten würde demnach eine Speicherfunktion zukommen, während die Spermidin-Synthese primär in Neuronen stattfindet.
Die Lokalisation der Syntheseenzyme erlaubt daher genauere Rückschlüsse auf mögliche Funktionen der Polyaminbiosynthese in bestimmten Zelltypen oder subzellulären Kompartimenten (z.B. Synapsen) als die Darstellung der Polyamine selbst. Die verstärkte Spermidin-Synthase -Expression in mehreren zentralen Hirnregionen, wie dem Striatum, Nucleus accumbens, Hippokampus, Klein- und Großhirnrinde, weist darauf hin, dass hier ein Bedarf besteht, der über den basalen, zellulären Polyamingehalt hinausgeht.
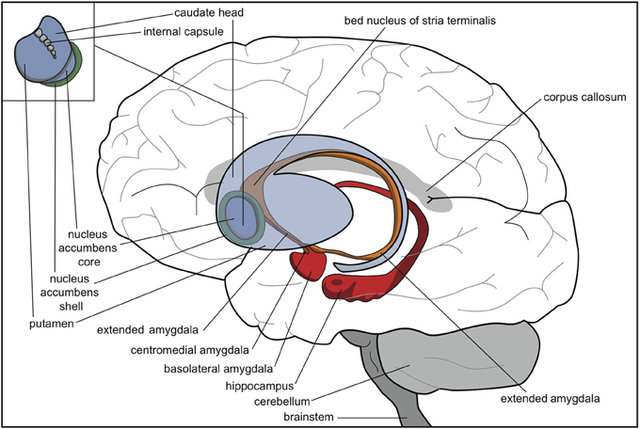
Abb. Menschliches Gehirn mit Striatum (blau), nuklearer Amygdala (orange), kortikaler Amygdala (rot) und Hippocampus (rot). © AJM Loonen.
Im Zentralnervensystem beeinflussen Spermidin und Spermin unter anderem die Funktion von Glutamatrezeptoren vom NMDA-Typ und AMPA/Kainat-Typ, sowie einwärtsgleichrichtender Kaliumkanäle (Kir-Kanäle)
Modulation der Glutamatrezeptoren
Spermin und Spermidin verbessern den antioxidativen Schutz für Neurone und Gliazellen durch Modulation der Glutamatrezeptoren.
Spermin kann die Dopaminbindung in synaptischen Vesikeln beeinflussen und ist die wichtigste Schutzwirkung von Polyaminen bei Morbus Parkinson und LOAD (Alzheimer Krankheit mit spätem Beginn).
Die oxdative Desaminierung von Dopamin durch Monoaminooxidase B scheint angesichts ihrer Rolle bei der oxidativer Stress -Induktion bei Morbus Parkinson und Alzheimer Krankheit durch die Bildung von Dopamin-Chinonen als einer der Auslösemechanismen für oxidativen Stress zu sein.
Einwärtsgleichrichtende Kalium-Kanäle (Inwardly rectifying potassium (K) channels, Kir-Kanäle)
Die Aktivität von Kir-Kanälen wird indirekt durch das Membranpotential gesteuert. Die Funktion dieser K+-Kanäle ist die Stabilisierung des Ruhemembranpotentials nahe dem K+-Gleichgewichtspotential.
Der einwärts gleichrichtende K+-Kanal wird bei einem Membranpotential, das negativer als das Kalium-Gleichgewichtspotential (ca. –90 mV) ist, aktiviert, was zu einem K+-Einstrom führt. Sobald das Membranpotential positivere Werte annimmt, wird der Auswärtsstrom über intrazelluläre Mg2+-Ionen und positiv geladene Polyamine wie Spermidin und Spermin unidirektional blockiert. Bei Depolarisation blockieren diese Moleküle die Kanalpore und verhindern somit weiteren K+ -Ionen Ausstrom.
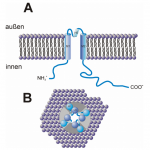
Abb. Schema eines Kir-Kanals
A: Integration eines Kir-Kanalproteins (α-Untereinheit) in der Plasmamembran. Amino- und Carboxy-Terminus liegen im Cytoplasma.
B: Aufsicht auf die Kanalpore. Vier Kir-Kanalproteine bilden den vollständigen Kanal. Bei diesem besteht der Kanal aus heterooligomeren Untereinheiten. Gleiche Untereinheiten sind farbig markiert.
Kir-Kanäle kommen nicht nur in den neuronalen sowie nichtneuronalen Zellen des ZNS (Zentrales Nerven-System) vor, sondern auch im Herzen, im Skelettmuskein, der glatten Muskulatur und in der Bauchspeicheldrüse vor.
Die Spermidin-Wechselwirkungen mit Proteinmembranrezeptoren haben Einfluss auf die synaptische Übertragung und die synaptische Plastizität, die dem Lernen und dem Gedächtnis zugrunde liegen
Spermidin und Spermin, sie haben in Kombination Wirkvorteile die größer sind als bei getrennter Anwendung, verändern den Durchfluss bei Ionenkanälen und wirken auf die Aktivitäten von ionotropen Glutamatrezeptoren, die den Durchtritt von Kationen durch die Zellmembran ermöglichen und auf die Bindung eines Liganden wie Glutamat reagieren.
Spermidin und Spermin sind so an der synaptischen Übertragung und der synaptischen Plastizität beteiligt, die dem Lernen und dem Gedächtnis zugrunde liegen.
Mehrere Anhaltspunkte deuten darauf hin, dass Spd/Spm über ihre modulatorische Wirkung auf NMDA-Rezeptoren möglicherweise Bedeutung für Mechanismen synaptischer Plastizität zukommt.
Im Striatum, das ein Teil der Basalganglien, die zum Großhirn gehören ist. deutet die Konzentrierung der Spermidin-Synthase (SpdS) im „Patch Compartment“ sowie in putativen Interneuronen des umgebenden „Matrix Compartments“ (es sind komplexe und gewundene 3D-Felder mit mehreren Ausdehnungen) auf eine funktionelle Rolle von Spermidin in den intrastriatalen „Patch/Matrix“-Schaltkreisen hin.
Abb. Matrix- und Striosomkompartimente
https://en.wikipedia.org/wiki/Striosome
Beteiligung der Polyamine an der Suchtpathogenese
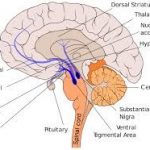
Abb. Mesolimbisches System
Das mesolimbische dopaminerge System, in dem Suchtverhalten über synaptische Plastizität vermittelt wird, stellt einen deutlichen Schwerpunkt der Spermidin-Synthase (SpdS)- Expression dar.
Zu diesem System gehören das ventrale tegmentale Areal (VTA), der Nucleus accumbens, der präfrontale Kortex, die Amygdala und der Hippokampus.
Unter diesen enthalten insbesondere der Nucleus accumbens, der Hippocampus und der basolaterale und zentrale Amygdalakern deutlich Spermidin-Synthase-positive Neurone. Die Spermidin-Synthase-Verteilung im Nucleus accumbens, besonders im dorsomedialen Anteil, ähnelte stark dem striatalen Patch/Matrix-Muster und könnte somit auf eine analoge funktionelle Organisation benachbarter neurochemischer Kompartimente hinweisen. Diese Spermidin-Synthase-positiven Areale überlappen zudem mit denjenigen Arealen, die vermehrt D1-Dopamin-Rezeptoren aber wenig D2-Dopamin-Rezeptoren exprimieren.
Die Spermidin-Synthase-Verteilung in den dopaminergen Arealen des Nucleus accumbens und die Tatsache, dass Dopamin bei der Suchtentstehung im Nucleus accumbens eine wesentliche Rolle spielt, lässt eine Beteiligung der Polyamine an der Suchtpathogenese denkbar erscheinen.
Beeinflussung von Gedächtnisleistungen durch Spermidin
Ein zentraler molekularer Prozess der synaptischen Plastizität ist die NMDA-Rezeptor-abhängige Langzeitpotenzierung (LTP), die im Hippokampus und der lateralen Amygdala nicht nur in glutamatergen Projektionsneuronen, sondern auch in inhibitorischen Interneuronen nachgewiesen wurde. In beiden Arealen wurde eine deutliche Spermidin-Synthase-Expression in Interneuronen beobachtet. Physiologische Experimente haben gezeigt, dass durch lokale Spermidin-Applikation, sowohl in der Amygdala als auch im Hippokampus, eine Beeinflussung von Gedächtnisleistungen erzielt werden konnte. Es erscheint somit möglich, dass endogenes Spermidin ähnliche Effekte hervorrufen kann.
Spermidin und Spermin, werden in Neuronen und Astrozyten synthetisiert und in sekretorischen Vesikeln gespeichert. Das Gen SLC18B1 codiert einen eigenständigen vesikulären Polyamintransporter (VPAT).
Astrozyten verfügen auch über Rezeptoren für Neurotransmitter und können selbst neuroaktive Substanzen sezernieren.
Morphologisch wird dieses Zusammenwirken durch Beteiligung am Synapsenaufbau deutlich (tripartite Synapsen):
An diesen tripartiten Synapsen werden Astrozyten durch Neurotransmitter über Bindung an Rezeptoren aktiviert, was intrazellulär Ca++ mobilisiert und zur Freisetzung von Gliotransmittern führt.
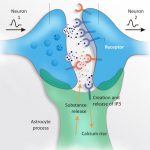
Abb. Dreigliedrige Synapse.
Am Beispiel des Neurotransmitters Glutamat:
Das prä-synaptische Terminal (Neuron 1) setzt den Neurotransmitter Glutamat in der synaptischen Spalte frei. Glutamat bindet an die postsynaptischen glutamatergen Rezeptoren (Neuron 2) und an die glutamatergen Rezeptoren im Astrozyten. Das Vorhandensein des Neurotransmitters löst somit eine Ca ++ – Welle im Astrozyten aus, die wiederum noch mehr Glutamat (in diesem Fall einen Gliotransmitter) freisetzen kann als das postsynaptische Neuron.
Spermidin als ein möglicher Neuro- / Gliotransmitter der Astrozyten.
Unter neurodegenerativen Bedingungen wird der Funktionsmangel der glioneurovaskulären Einheiten durch ein Ungleichgewicht im Glia / Neuron-Verhältnis und im Gliazellenverhältnis zwischen Astrozyten und Mikroglia bestimmt.
Die Tatsache, dass Polyamine in Neuronen produziert, aber in Glia akkumuliert werden, ermöglichte es, eine Hypothese vorzuschlagen, dass Polyamine als Gliotransmitter mit einer neuroregulatorischen Funktion wirken. Darüber hinaus erreichen Glia-Polyamine in bestimmten Fällen Neurone über Endothel- und Gehirnkapillaren.
Synergistische Wirkung von Spermidin und Stickstoffmonoxid zur Steigerung der Gedächtnisleistung
Das gemeinsame Vorkommen von Spermidin-Synthase und neuronaler Stickoxidsynthase in hippokampalen Interneuronen könnte auf eine synergistische Wirkung von Spermidin und Stickstoffmonoxid (NO) hinweisen.
Es konnte gezeigt werden, dass NO nicht nur an N-Methyl-D-Aspartat (NMDA)-Rezeptor vermittelter synaptischer Plastizität beteiligt ist, sondern offenbar auch mit den die Gedächtnisleistung steigernden Effekten von Spermidin in einem engen funktionellen Zusammenhang zu stehen scheint.
Der altersabhängige Rückgang der Erinnerungsfähigkeit kann durch die Verabreichung der natürlichen Substanz Spermidin gestoppt werden.
Das ist das Ergebnis mehrerer Studien aus dem Labor von Professor Madeo (Universität Graz) in Kollaboration mit Prof. Dr. Stephan Sigrist und Prof Dr. Agnes Flöel von der Freien Universität Berlin sowie dem Exzellenzcluster Neurocure, einem interdisziplinären Forschungsverbund im Bereich der Neurowissenschaften an der Charité – Universitätsmedizin Berlin.
Im zerebralen Kortex sind kräftige Spermidin-Synthase-positive Neurone, überwiegend in Schicht I, lokalisiert. Die Lamina molecularis (Schicht I) besteht vor allem aus Fortsätzen von tiefer gelegenen Neuronen. Ein Großteil dieser Neurone enthielt außerdem Reelin, ein Glycoprotein mit einem Molekulargewicht von etwa 400 kD, das von Cajal-Retzius (CR)-Zellen der Marginalzone der Hirnrinde gebildet wird, das an synaptischer Plastizität beteiligt ist und die Aktivität von NMDA-Rezeptoren moduliert.
Die GABAergen Neurone enthalten als Neurotransmitter die Aminosäure GABA (γ-Aminobuttersäure) und ist der wichtigste inhibitorische Neurotransmitter.
Da die Mehrzahl der Schicht I-Neurone GABAerg ist und auch die Mehrheit der Reelin positiven Neurone GABA enthält, deutet die prominente Spermidin-Synthase-Expression in diesen Zellen auf eine funktionelle Beteiligung von Spermidin und/oder Spermin an inhibitorischen kortikalen Schaltkreisen hin. Diese Interpretation wird durch die Tatsache unterstützt, dass Schicht I-Neurone sowohl untereinander als auch mit Pyramidenzellen der Schichten II/III synaptische Kontakte bilden.
Spermin schützt durch BDNF- und TrkB-Aktivierung vor LPS-induziertem Gedächtnisdefizit
Es ist seit langem bekannt, dass Lipopolysaccharid (LPS) Neuroinflammation und Lern- und Gedächtnisdefizite fördert.
Die schützende Wirkung von Spermin auf LPS-induzierte Gedächtnisdefizite hängt von der Tropomyosin Rezeptorkinase B (TrkB)-Rezeptoraktivierung ab und geht mit der Wiederherstellung eines reifen „Brain-derived neurotrophic factor“ (BDNF)-Spiegels im Hippocampus und in der Großhirnrinde, sowie einer erhöhten „cAMP response element-binding protein“ (CREB)-Phosphorylierung eines Transskriptionsfaktor in der Großhirnrinde einher.
„Brain-derived neurotrophic factor“ (BDNF) ist ein Protein aus der Gruppe der Neurotrophine und ist mit den Nervenwachstumsfaktoren eng verwandt.
Der Polyamintransporter Slc18b1 (VPAT) ist wichtig für das Kurz- und Langzeitgedächtnis sowie für die Regulation des Polyamingehalts im Gehirn
SLC18B1 ist ein Schwestergen der vesikulären Monoamin- und Acetylcholintransporter und ist der einzige bekannte Polyamintransporter mit unbekannter physiologischer Rolle.
Slc18b1 ist zur Regulierung des Polyamingehalts funktionell erforderlich. Bei fehlender Expression von SLC18B1 ist das Kurz- und Langzeitgedächtnis beeinträchtigt und die Expression von Genen verändert, die an der Langzeitpotenzierung, Plastizität, Kalziumsignalisierung und synaptischen Funktionen beteiligt sind und die Expression von Komponenten der GABA- und Glutamat-Signalisierung verändert.
Die fehlende Expression von Slc18b1 führt zu einer Verringerung des Polyamingehalts in Neuronen, was zu einer verringerten GABA-Signalübertragung aufgrund einer langfristigen Verringerung der glutamatergen Signalübertragung führt.
Ist die Alzheimer-Krankheit eine Autophagie-Dysfunktion? – Neuritische Dystrophie bei Alzheimer-Krankheit durch Beeinträchtigung der Clearance von autophagischen Vakuolen (AVs)
Analysen deuten darauf hin, dass Synapsen in Alzheimer Demenz-Gehirnen möglicherweise nicht mehr funktionieren, noch bevor sie sichtbar degenerieren.
Innerhalb von Neuronen, in Synapsen und entlang neuritischer Fortsätze bilden sich Autophagosomen und Endosomen.
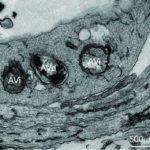
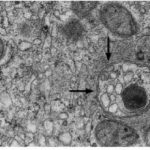
Abb. Autophagosome (AVi) und Autolysosome (AVD) in einer gedehnten Region von einem Neuriten.
Autophagosomen und andere autophagische Vakuolen-Subtypen reichern sich zusammen mit Hydrolase-positiven, dichten Körpern zunehmend in großen Mengen in stark aufgedehnten dystrophen Neuriten an und werden zu den Hauptorganellen in diesen Strukturen.
Die ausgedehnte neuritische Dystrophie bei Alzheimer Krankheit und charakteristische, stark gedehnte Neuriten, die fast vollständig mit autophagische Vakuolen (AVs) gefüllt sind, stellen daher eine einzigartig große autophagiebezogene „Last“ im Alzheimer- Demenz- Gehirn dar.
Autophagische Vakuolen (AVs) und das Amyloid-Precursor-Protein (Amyloid-Vorläuferprotein, APP) häufen sich auch nach Beleidigungen von Axonen an, wie z. B. einer traumatischen Hirnverletzung, die mit einer erhöhten lokalen Produktion und Ablagerung von Beta-Amyloid (Aβ) verbunden und ein Risikofaktor die für Alzheimer Krankheit ist .
Vom Lysosom zum Autophagolysosom
Das „Lysosomenkonzept“ des Nobelpreisträgers De Duve – Nobelpreis für Physiologie oder Medizin 1974
1955 entdeckte Christian de Duve bisher unbekannte Organellen in der Zelle, Lysosomen.
Lysosomen als Kläranlage: Verhinderung einer Zellverseuchung durch Abbau von Schadstoffen wie Bakterien (=Heterophagie),
Prälysosomale Phase der Heterophagie
Heterophagie ist die zelluläre Aufnahme von zellfremden, belebtem oder unbelebtem Material. Sie wird als Phagozytose bezeichnet, wenn es sich um lichtmikroskopische Partikel handelt. Die Aufnahme von makromolekularem Material hingegen nennt man Pinozytose, die Aufnahme von Zellsignalen hingegen Endozytose. Der Phagozytosevorgang läuft in folgenden drei Phasen ab: Erkennungsphase, Aufnahmephase und Verdauungsphase:
Der Kontakt mit dem Fressmaterial aktiviert die Fresszelle. Diese enthalten Enzymsysteme wie NADPH-Oxidase und NO-Synthase. Mit Hilfe der NADPH-Oxidase generieren die Fresszellen mit einem Schlag toxische Sauerstoffverbindungen in Form von -OH, Superoxidradikal und H2O2, was auch als „Respiratory Burst Reaction“ bezeichnet wird. Mittels Myeloperoxidase und Chloridionen wird H2O2 zu HClO (= hypochlorige Säure) umgesetzt. Mit Hilfe der NO-Synthase hingegen entstehen toxische Stickstoffverbindungen in Form von NO, das zusammen mit Superoxidradikalen zu Peroxynitril umgewandelt wird. Diese Verbindung ist bakteriotoxisch und reichert sich ebenso wie die Hydrolasen aus primären Lysosomen in der lysosomalen Verdauungsvakuole an, so dass die Verdauung des Fremdmaterials wie Bakterium (unter anderem) beginnen kann.
Lysosomale Phase: Heterophagie
Bei der Heterophagie (gr. = „Fremd-Aufzehrung“) verschmilzt in der lysosomalen Phase die Heterophagievakuole samt Fremdinhalt zur Abgabe ihrer Verdauungsenzyme mit einem intrazellulären Hydrolasebehälter in Form primärer Lysosomen, wodurch ein Heterophagosom entsteht. Damit kann der Abbau des Fremdmaterials beginnen.
Lysosomen als Betriebsoptimierung: Abbau unnütz gewordener Zellbestandteile (= Autophagie),
Prälysosomale Phase: Autophagie
Bei der Autophagie (gr. = „Selbst-Aufzehrung“) wird zelleigener „Sondermüll“ abgebaut. Dabei wird in der prälysosomalen Phase ein geschädigtes Zytoplasmaareal durch eine Doppelmembran (Golgiassoziierte RER-Zisterne) abgegrenzt, so dass eine Selbstverdauungsvakuole (=Autophagievakuole) entsteht.
Lysosomale Phase: Autophagie
Ist das für den lysosomalen Abbau vorgesehene Zytoplasmaareal inForm einer Autophagievakuole umschlossen – was man als Seggregation bezeichnet – , so werden durch Auflösung der inneren Vakuolenmembran sowie durch Fusion mit lysosomalen Hydrolasebehältern katabole Enzyme in die Autophagievakuole eingeschleust. Dadurch wird aus dem Autophagosom ein Autophagolysosom, so dass die Verdauung des Vakuoleninhalts beginnen kann.

Abb. Autophagolysosom mit peroxisomhaltigem Zytoplasmabezirk
Lysosomen als Mülldeponie: Entsorgung von Zellschutt (= Telolysosom)
Postlysosomale Phase
Die Auto- und Heterophagolysosomen können, wenn der Abbau des intravakuolären Materials abgeschlossen ist, in der postlysosomalen Phase entweder als Telolysosomen (= Restkörper) in der Zelle verweilen. Die Telolysosomen können aber auch von bipolaren Zellen wie den Hepatozyten über eine Exozytose in den Extrazellulärraum ausgeschieden werden. Dieser Vorgang wird auch zelluläre Defäkation genannt.
In alternden Telolysosomen führt die zunehmende Ansammlungnicht vollständig abbaubarer Substanzen zu einer gelblichen oderspäter braunen Pigmentierung, was durch ihren Gehalt an oxidativ vernetzten Fettsäuren bedingt ist. Ultrastrukturell bestehen diese Pigmente aus Lipidtropfen, myelinartig angeordneten Strukturen und amorph-granulärem Material. Solche lysosomalen Lipopigmente lassen sich formalpathogenetisch in folgende zwei Hauptgruppen
unterteilen: Lipofuszin und Zeroid.
Die Beeinträchtigung der Clearance von autophagischen Vakuolen (AVs) und ihres Inhalts durch Lysosomen ist möglicherweise ein noch entscheidenderer Faktor als die Autophagie-Induktion bei der Entwicklung der Alzheimer-Pathologie.
Eine beeinträchtigte Reifung von autophagische Vakuolen (AVs) zu Lysosomen wurde beschrieben ( Nixon et al., 2005 ). Ein weiterer Beweis für eine beeinträchtigte autophagische Vakuolen (AV)-Clearance bei Alzheimer Krankheit (AD) ist die Beobachtung, dass Mutationen in Presenilin-1 (PS1) eine familiäre Alzheimer Krankheit mit frühem Beginn verursachen und die Pathologie des lysosomalen Systems, die Amyloidogenese und die Neurodegeneration bei dieser Störung potenzieren. Presenilin-1 ist eines der vier Kernproteine im Gamma-Sekretasekomplex, von dem angenommen wird, dass es eine wichtige Rolle bei der Erzeugung von Beta-Amyloid (Aβ) aus Amyloid-Vorläuferprotein (APP) spielt.
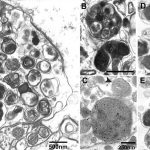
Abb. Ultrastruktur von autophagische Vakuolen (AVs) im Alzheimer-Demenz- Gehirn
Alzheimerpatienten haben im Durchschnitt 35% niedrigere Polyaminwerte als ältere Menschen mit gesunden Gehirnfunktionen.
Referenzen auf Anfrage erhältlich.
Ihr
Eduard Rappold
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS
Sojapulver mit
SPERMIDIN und high-quality-SOJAPROTEIN
Spermidin induziert die Autophagie (Müllentsorgung aus der Zelle)
und verringert das
Risiko für neurodegenarative Erkrankungen
Auch in Nervenzellen fällt Müll an,
zu sehen hier in rot und grün.

40 Portionen
mit
mehr als 1,7mg SPERMIDIN pro Messlöffel
www.spermidine-soyup.com
