Was ist Epigenetik?
Unter Epigenetik versteht man molekulare Mechanismen am Genom. Sie führen zu einem stärkeren oder schwächeren Ablesen von Genen, ohne dass das Genom, der Bauplan des Körpers, verändert wird.
Wir sprechen vom Epigenom, als einer durch DNA-Modifikationen geregelten Schnittstelle, die sich zwischen dem Genom und den Einflüssen von außen, wie der Umwelt und dem Verhalten, befindet.
Die epigenetisch regulierte Genexpression ist eine Folge chemischer Modifikationen. Diese Markierungen am Genom und spielen beim Ein- und Ausschalten der Gene eine wichtige Rolle.
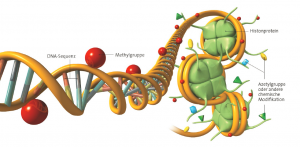
Abb. Chemische Markierungen, die sogenannten Methylgruppen oder Acetylgruppen sagen der Zelle, welche Gene exprimiert und welche stumm bleiben sollen
Umwelt und Epigenom
Das Epigenom ist die Software, die der Hardware, den Genen, Arbeitsaufträge erteilt.
Das im Wandel befindliche Epigenom ist für die verschiedenen Erscheinungen verantwortlich, die ein Mensch als Ganzes im Zuge seiner Anpassung annehmen kann (phänotypische Plastizität).
Es kommt zu einem Zusammenspiel von Umweltsignalen, eigenem Verhalten und Erfahrungen und dem Epigenom bei der Regulation individueller Unterschiede im Verhalten, Kognition und Physiologie.
Umweltsignale können sowohl während der frühen Entwicklung als auch im Erwachsenenalter intrazelluläre Signalwege aktivieren, die das „Epigenom“ direkt umgestalten, was zu Veränderungen der Genexpression und der neuralen Funktion führt.
Die Genomsequenz eines mehrzelligen Organismus ist im gesamten Körper identisch, aber Zellen in unterschiedlichen Geweben haben unterschiedliche Epigenome, die unterschiedliche Genexpressionsprogramme steuern.
Mit anderen Worten, das Genom definiert die potenzielle genetische Information, indem das Epigenom definiert, welche Gene dieses potenziellen Repertoires tatsächlich exprimiert. Diese Regulation der Genexpression ohne Veränderung der DNA-Sequenz wird durch epigenetische Modifikationen ermöglicht.
Epigenetik bezieht sich auf eine Vielzahl von Prozessen, die die Genexpression unabhängig von der tatsächlichen DNA-Sequenz beeinflussen. Epigenetische Informationen enthalten Anweisungen, wie, wo und wann genetische Informationen verwendet werden. Die epigenetische Information hat daher die Bedeutung, dass sie die Genexpression reguliert.
Epigenetik kann sich auf vererbbare Wirkungen auf die Genexpression oder auf die stabile langfristige Veränderung des Transkriptionspotentials einer Zelle beziehen.
Am wichtigsten ist, dass epigenetische Informationen anfällig für Veränderungen sind. Sie stellen als solche ein hervorragendes Ziel dar, um zu verstehen, wie sich die Umgebung auf die physiologische Funktion auswirken kann. Der Effekt kann vorübergehend (während der Dauer) oder länger (nachhaltig) sein.
Während sich die Epigenetik auf Auswirkungen auf einzelne und / oder Gruppen von Genen bezieht, bezieht sich die Epigenomik auf globale epigenetische Modifikationen, die das gesamte Genom umfassen.
Meilensteine der Epigenetik
◊ 1809 Jean-Baptiste Lamarck beschreibt die Evolutionstheorie. Die Erbinformation ist durchaus veränderbar
◊ 1953 James D. Watson und Francis Crick entschlüsseln die DNA-Struktur
◊ 1975 Robin Holliday und Arthur Riggs entdecken, dass Methyl-Gruppen die Aktivität von Genen kontrollieren können
◊ 1990 Richard Jorgensen und Antoine Stuitje beschreiben das Phänomen der Ko-Suppression
◊ 1998 Andrew Fire and Craig C. Mello zeigen, dass doppelsträngige RNA, Gene inaktivieren kann und nennen dies RNA- Interferenz (RNAi)
◊ 1999 Ein englisches Forscherteam beweist, dass die Blütenform der von Linné entdeckten Pflanze Peloria epigenetisch modifizierbar ist
◊ 2012 Die Resultate des Projekts ENCODE zeigen, dass bisher als funktionslos geltende DNA- Bereiche für die Steuerung der Gene verantwortlich sind
Erbinformation ist durchaus veränderbar, ohne Änderung der Abfolge der DNA
Durch Umwelteinflüsse kann die Genaktivität, ohne Änderung der Abfolge der DNA-Buchstaben, beeinflusst werden und anschliessend an Tochterzellen oder die nächste Generation vererbt werden. Man könnte sagen «Gene haben ein Gedächtnis».
Neue Forschung zeigt, dass die Entstehung von Krankheiten oder die Veränderung von Persönlichkeitsmerkmalen epigenetisch beeinflusst werden.
Abb. NIH Roadmap Epigenomics Mapping Consortium
Zu den Werkzeugen der Epigenetik , die zur epigenetische Modifikation zählen:
- DNA-Methylierung
- Histonmodifikation
- Chromatin-Remodellierung und
- micro-RNAs
DNA-Modifikationen: die erste epigenetische Dimension
Bereits 1975 entdeckten Robin Holliday und Arthur Riggs unabhängig voneinander, dass chemische Veränderungen der DNA durch das Hinzufügen von kleinen Molekülen, sogenannten Methyl-Gruppen, die Aktivität von Genen kontrollieren können. Diese Methyl-Gruppen können an die DNA-Base Cytosin geknüpft werden und es resultiert die Stummschaltung (Inaktivierung) des betroffenen DNA-Abschnitts.
In unserem Erbgut finden sich insbesondere in der Nähe von Genen DNA Abschnitte, die einen überdurchschnittlich hohen Anteil an Cytosin-Basen aufweisen. Diesen sogenannten CpG-Inseln, so benannt, da hier abwechselnd eine Cytosin-Base auf eine Guanin-Base folgt, kommt daher eine wichtige Regulationsfunktion der Genaktivität zu. Dabei gilt, je mehr Methyl-Gruppen eine bestimmte DNA-Sequenz hat, desto weniger wird das Gen abgelesen und in Proteine übersetzt.
DNA-Methylierungen sind essentiell für die normale Entwicklung eines Organismus. Sie spielen eine entscheidende Rolle bei der Vererbung, 〈Anmerkung (1)〉, sowie der Erhaltung eines intakten Genoms 〈Anmerkung (2)〉 . Fehlen einem Organismus hingegen die für die Methylierung wichtigen Enzyme, hat dies schwerwiegende Krankheiten zur Folge.
(1) GENOMISCHE PRÄGUNG
Unter dem Begriff genomische Prägung (engl.: Imprinting) versteht man das Phänomen, dass die Aktivität eines Gens davon abhängig sein kann, von welchem Elternteil das jeweilige Allel stammt. Bei Genen, die dieser epigenetischen Regulation unterliegen, ist entweder das mütterliche oder das väterliche Allel inaktiviert. Heute weiss man, dass vor allem DNA-Methylierungen für diesen Prozess verantwortlich sind und zur Inaktivierung der entsprechenden Gene führen.
(2) SCHUTZ VOR MOBILEN DNA-ELEMENTEN
Die Sequenzierung des Genoms hat gezeigt, dass mobile DNA-Segmente, beispielsweise
Transposons («springende Gene»), einen grossen Teil unseres Erbgutes ausmachen.
Diesen Elementen ist es möglich, katalysiert durch verschiedene Prozesse, an einen anderen Ort im Genom zu «springen». Da bei diesem Schritt die Gefahr besteht, die Aktivität von Genen zu
beeinträchtigen oder gar ganz zu stören, haben Zellen Wege gefunden, diese Elemente
stumm zu schalten. Eine Reihe epigenetischer Mechanismen wie Chromatinmodifikationen,
DNA-Methylierungen sowie die RNAi-Maschinerie (Prozess, welcher in Eukaryoten nach der Transkription zur Stilllegung von Genen führt) übernehmen diese Funktion.
DNA-bindende Proteine: die zweite epigenetische Dimension
Eine weitere Möglichkeit, die Genaktivität zu regulieren, ist die Steuerung der Verpackung der DNA. Die DNA ist im Zellkern auf Eiweiße, sogenannte Histone, aufgewickelt und in komplexen Strukturen organisiert, dem Chromatin.
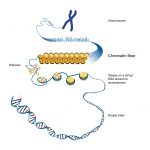
Historisch gesehen liegt die Entdeckung von Chromatinmodifikationen fast ein halbes Jahrhundert zurück. Jedoch erst im 21. Jahrhundert erkannten Wissenschaftler, dass chemische
Veränderungen an den Chromatin- Untereinheiten, den Histonen, allein oder in Kombination den Zugang zur DNA regulieren können. Diese Modifikationen wie Methylierungen, Acetylierungen oder Phosphorylierungen führen zu Veränderungen der Chromatinstruktur und bestimmen so, ob ein
Gen aktiv oder inaktiv ist.
Stark verdichtetes Chromatin, sogenanntes Heterochromatin, wird mit geringer Genaktivität assoziiert, während Euchromatin weniger stark gepackt ist und mit hoher Genaktivität verbunden wird.
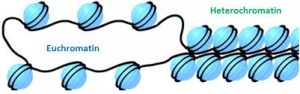
Abb. 92% des menschlichen Genoms sind euchromatisch
In Anbetracht der Vielfalt an möglichen chemischen Modifikationen sowie der Tatsache, dass kurze DNA-Abschnitte auf Histon-Oktamere, bestehend aus fünf verschiedenen Histonproteinen,
aufgewickelt sind, ist die Kombination möglicher Chromatinmodifikationen enorm. Diese Komplexität veranlasste Forscher zur Postulierung eines Histon-Codes, welcher während den Prozessen der Zellteilung und Zellspezialisierung erhalten bleibt.
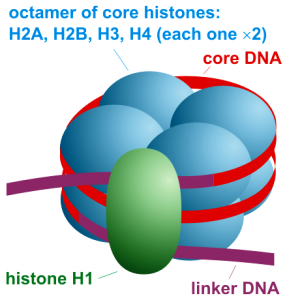
Abb. Nucleosom
Histonmodifikationen regulieren viele Aspekte der Entwicklung eines Organismus, angefangen von der Regulation eines einzelnen Gens bis hin zu komplexen Vorgängen wie der Bestimmung des Zellschicksals.
Anormalitäten bei Histonmodifikationen, ausgelöst beispielsweise durch Umwelteinflüsse, können zu Erkrankungen führen. Derartige Zusammenhänge hat man bereits bei Parkinson, Multipler Sklerose und Epilepsie nachweisen können.
RNA-Moleküle: die dritte epigenetische Dimension
RNA-Moleküle
Bei RNA handelt es sich ähnlich wie bei DNA um eine Nukleinsäure. Im Gegensatz zur DNA ist diese jedoch einsträngig und enthält anstelle der Nukleinbase Thymin die Nukleinbase Uracil. Die RNA ist essentiell für die Übersetzung der genetischen Information der DNA in Proteine.
Hierzu wird eine RNA-Kopie eines Gens im Zellkern erstellt, die sogenannte Boten-RNA (engl.: messenger RNA; mRNA). Im Anschluss wird die mRNA im Zytoplasma in Eiweisse (Proteine) übersetzt.
Neben der mRNA, welche der Produktion von Proteinen dient, gibt es auch RNA-Moleküle, die nicht in Proteine übersetzt werden. Man nennt solche RNA-Moleküle auch nicht-kodierende RNAs (miRNA). Einige können an bestimmte DNA-Bereiche binden und zusammen mit weiteren Faktoren zur Bildung von Heterochromatin und DNA-Methylierung führen.
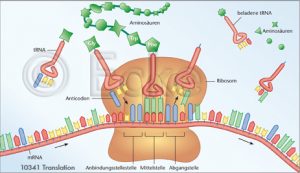
Abb. Translation
Dopelsträngige RNA besteht aus zwei komplementären einsträngigen RNA-Molekülen.
Diese Form der RNA ist Träger der Erbinformation einiger Viren, analog zur DNA.
Zellen von Pflanzen, Tieren und Menschen produzieren jedoch auch eigene kurze, doppelsträngige RNA-Moleküle, sogenannte miRNAs. Diese entsteht, wenn einsträngige RNA sich zusammenlagert und dabei eine haarnadelähnliche Struktur bildet.
Ein Mechanismus, der durch das Vorhandensein von doppelsträngiger RNA aktiviert wird, ist die RNA-Interferenz. Hierbei wird doppelsträngige RNA erkannt und in kurze Abschnitte zerschnitten. Diese können, mit Hilfe weiterer Faktoren, an mRNAs binden und diese zerstören. Dies führt schliesslich zur Blockade der entsprechenden Proteinproduktion.
Beispielsweise können miRNAs helfen, geschlechtsspezifische Unterschiede in der Pathophysiologie von Depressionen zu erklären.

Im Jahr 2006 wurden Andrew Fire und Craig C. Mello „for their discovery of RNA interference – gene silencing by double-stranded RNA.“ mit dem Nobelpreis für Medizin ausgezeichnet.
Das Human-Genom-Projekt brachte uns im Jahr 2001 eine Reihe neuer Erkenntnisse und eröffnete neue Dimensionen im Bereich der Grundlagenforschung und angewandten medizinischen Forschung. Mit seinen Resultaten kam aber auch die Erkenntnis, dass mehr als 90 Prozent der DNA-Sequenz bislang keiner Funktion zugeordnet werden kann.
Diese Wissenslücke zu schliessen hatte sich ein internationales Forscherkonsortium, bestehend
aus über 440 Wissenschaftlern aus 32 Laboren weltweit, zur Aufgabe gemacht. Das Projekt erhielt den Namen ENCODE (The Encyclopedia of DNA Elements). Dessen vorläufige Ergebnisse zeigen, dass ein wesentlicher Bestandteil dieser bislang als funktionslos geltenden DNA für die Steuerung der Aktivität von Genen zuständig ist.
Literatur:
Beisel Ch. & Paro R., 2011. Silencing chromatin: comparing modes and mechanisms; Nature Reviews Genetics; 12: 123-135.
Bird A., 2007. Perceptions of epigenetics; Nature, 447, 396-398.
Chahwan R. et al., 2011. The multidimensional nature of epigenetic information and its role in disease; Discov. Med.; 11(58):233-43.
Choudhuri S., 2011. From Waddington`s epigenetic landscape to small noncoding RNA: some important milestones in the history of epigenetics research,
Toxicology; Mechanisms and Methods, 21, 252-274.
Crews D., et al., 2012. Epigenetic transgenerational inheritance of altered stress responses; PNAS, 109(23), 9143-9148.
Eccleston et al., 2007. Epigenetics; Nature; 447, 395.
Feinberg A.P., 2007. Phenotypic plasticity and the epigenetics of human disease; Nature; 24(447), 433-440.
Holliday R. et al., 1975. DNA modification mechanisms and gene activity during development; Science, 187, 226-232.
Jenuwein T. & Allis D., 2001. Translating the histone code; Science; 293:1074-1080.
Jones P. A., 2012. Functions of DNA methylation: islands, start sites, gene bodies and beyond; Nature; 13: 484-492.
Kouzarides T., 2007. Chromatin modifications and their function; Cell; 128: 693-705.
Marx V., 2012. Reading the second genomic code; Nature, 491, 143-147.
Riggs A, 1975. X-Inactivation, differentiation, and DNA methylation; Cell Genet., 14, 9-25.
Russo V. et al., 1996. Epigenetic Mechanisms of Gene Regulation; Cold Spring Harbor Laboratory Press, Woodbury.
Strahl B.D. et al., 2000. The language of covalent histone modifications;
Nature, 403, 41-45.
Waddington C.H., 1957. The strategy of the genes; Allen & Unwin.
Stiftung Gen Suisse, Bern
Prävention (Gesundheitsvorsorge) bei alterabhängiger und erworbener Untermethylierung der Erbsubstanz
Ademetionin ist der singuläre Methylgruppen-Donator für unsere Erbsubstanz und verhindert die Untermethylierung am Genom. Zugleich ist Ademetionin für die Spermidin-Biosynthese essentiell.
Ademetionin ist ein chirales Molekül und besteht aus zwei Formen:
(S, S), die biologisch aktive Form
(R, S), biologisch inaktive Form
Die Produktion von S-Adenosylmethionin (Ademetionin) beim Menschen findet hauptsächlich in der Leber statt.
Ein lebergesunder, unter 30 Jahre alter Erwachsener synthetisiert ungefähr 8 g S-Adenosylmethionin (Ademetionin) pro Tag.
Das natürliche Vorkommen von Ademetionin in der Zelle und seine Biosynthese in den Leberzellen, nehmen mit dem 35. Lebensjahr ab.
Dieser vom Lebensalter abhängige Ademetionin-Mangel hat eine altersabhängige Hypomethylierung (Untermethylierung) der Erbsubstanz zur Folge.
Auch der Spermidingehalt in den Zellen und die Spermidin-Synthese nimmt vor dem 40. Lebensjahr deutlich ab.
Die Synthese von Spermidin erfolgt durch Amino-Propylierung. Für die Synthese von Spermidin und Spermin ist S-Adenosylmethionin (Ademetionin) notwendig.

Abb. In den Produkten der Angewandten Epigenetik von NUGINIS liegt Ademetionin in seiner biologisch aktiven Form in einer präventiven Dosis vor.
Ihr Eduard Rappold
