
Proteopathien (Proteinfehlfaltungserkrankungen) und die Rolle von Spermidin
Proteopathien (Proteinfehlfaltungserkrankungen) und die Rolle von Spermidin
Spermidin hilft bei der allgemeinen Proteinsynthese durch ordnungsgemäße Faltung bestimmter tRNA-Spezies, das sich auf die Translationstreue auswirkt und regt die Autophagie an, einen Selbstreinigungsprozess der Zellen.
Als Proteinfehlfaltungserkrankungen bezeichnet man solche Erkrankungen, die durch falsch gefaltete Proteine innerhalb und außerhalb von Zellen verursacht werden. Entweder werden die fehlgefalteten Proteine in den Zellen eingelagert oder im Proteasom abgebaut. Das Proteasom baut als Bestandteil der Proteinqualitätskontrolle Proteine zu Fragmenten ab und zählt daher zu den Peptidasen. Im ersten Fall bilden sich dabei toxische Ablagerungen (Plaques), im zweiten tritt ein Funktionsverlust, bedingt durch einen Mangel des entsprechenden Proteins in der Zelle beziehungsweise im gesamten Organismus, ein. Beides kann über die Zeit für den Organismus pathologisch werden, wenn die Proteinentsorgung stoppt und abhängig vom betroffenen Protein zu unterschiedlichen Erkrankungen führen.
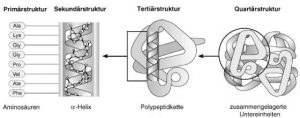
Abb. Strukturebenen von Proteinen
Die Primärstruktur entspricht der Sequenz der durch Peptidbindungen miteinander verbundenen Aminosäuren. Die entstehenden Polypeptide können, wie in vorliegendem Beispiel, zu einer α-Helix gewunden sein, die eine der möglichen Sekundärstrukturen darstellt. Die Helix ist Teil der Tertiärstruktur des gefalteten Polypeptids. Dieses wiederum stellt eine der Untereinheiten dar, welche die Quartärstruktur des multimeren Proteins, im vorliegenden Beispiel des Hämoglobins, bilden.
Für eine korrekte Funktion eines Proteins ist dessen Tertiärstruktur von entscheidender Bedeutung. Diese Struktur wird durch einen Prozess erreicht, der Proteinfaltung genannt wird.
Die Proteinfaltung ist ein komplexer und empfindlicher Vorgang. Die korrekte Proteinfaltung wird von der Proteinqualitätskontrolle überwacht. Statistisch gesehen werden etwa 30 % aller Proteine aus der Proteinbiosynthese nicht korrekt gefaltet und normalerweise innerhalb von etwa zehn Minuten im Proteasom der Zelle abgebaut.
Wahrscheinlich sind Polyamine für die ordnungsgemäße Faltung bestimmter tRNA-Spezies in verschiedenen Stadien der Proteinsynthese entscheidend und chelatisierte Polyamine und zweiwertige Ionen spielen unterschiedliche strukturelle Rollen, wobei Polyamine einfache organische Kationen, analog zu Mg 2+ und K + sind.
Unfolded Protein Response unterdrückt die Translation (Proteinsynthese)
Die Ansammlung von Proteinen mit fehlerhafter Faltung im endoplasmatischen Retikulum führt zur Unfolded Protein Response, einer Stressantwort der Zellen, die mit einer Unterdrückung der Translation und einer verstärkten Synthese von Chaperonen verbunden ist.
Chaperone sind Proteine, die neu synthetisierten Proteinen „helfen“, sich korrekt zu falten.
Das über einen Transportprotein in das Endoplasmatischen Retikulum (ER) eingeschleuste lineare ungefaltete Protein beginnt sich mit der Hilfe von Chaperonen zu falten. Wird es von der Proteinqualitätskontrolle als korrekt gefaltet erkannt, wird es per Vesikel aus dem Endoplasmatischen Retikulum ausgeschleust.
Fehlgefaltete Proteine werden über ein Transportprotein in das Zytosol weitergegeben und dort in einem Proteasom in Fragmente zerlegt. Amorphe Aggregate können auch über Autophagozytose abgebaut werden.
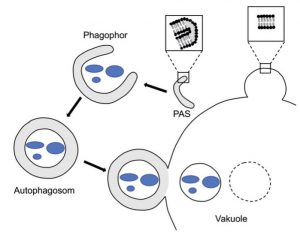
Abb. Autophagie:
Am PAS (phagophore assembly site) entsteht der hufeisenförmige Phagophor aus einer doppelten Membran, wodurch Autophagie zu einem einzigartigen intrazellulären Transportweg wird. Der Phagophor schließt sich zur Bildung des Autophagosoms, das eine Doppelmembran besitzt. Es wird zur Vakuole (Lysosom) transportiert und fusioniert mit der vakuolären Membran. In der Vakuole befindet sich nun ein Vesikel, das von einer einfachen Membran umgeben ist. Diese wird durch spezielle Enzyme lysiert, und der cytosolische Inhalt der Autophagosomen wird abgebaut.
Werden zu viele Moleküle wegen Fehlfaltung abgebaut, so kann dies zu einem Funktionsverlust in der Zelle oder im ganzen Organismus führen. Bilden sich zu viele unlösliche, nicht mehr abbaubare Aggregate, so entstehen toxische Ablagerungen in den Zellen und außerhalb.
Die Akkumulation von fehlgefalteten Proteinen in unlöslichen Aggregaten im neuronalen Zytoplasma ist eines der häufigsten pathologischen Merkmale der meisten neurodegenerativen Erkrankungen des Menschen, wie die Amyloidoangiopathie und Amyloidopathie bei der Alzheimer-Krankheit.
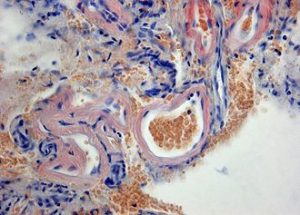
Histopathologie der zerebralen Amyloidangiopathie mit Ablagerung von Amyloid (rot) in der Wand hyalinisierter meningealer Gefäße.
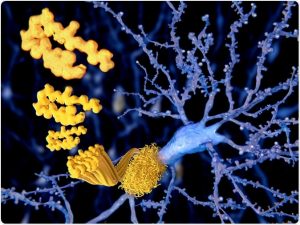
Das Beta-Amyloid-Peptid, Amyloid-Plaques, die auf einem Neuron wachsen. Es besteht aus etwa 30 Aminosäuren und Aggregaten zu Amyloid-Plaques, die Neuronen schädigen und abtöten können.
Bildnachweis: Juan Gaertner / Shutterstock
Die beiden Hauptwege für den intrazellulären Proteinabbau sind das Ubiquitin-Proteasom und der Autophagie-Lysosom-Weg mit dem Autophagieinduktor Spermidin.
Serum-Spermidin-Konzentrationen sind altersabhängig
Wenn wir von einem geschätzten Spermidin-Tagesbedarf von 12mg% ausgehen, dann sinkt die Spermidin-Bioproduktion in den ersten 40 Lebensjahren um ein Drittel. Im 80.Lebensjahr produziert der Körper nur mehr 33% seines Spermidin-Bedarfes.
Spermidin muss dem Körper täglich zugeführt werden.
Die Serum-Spermidin-Konzentrationen von 73 gesunden Kontrollen wurden in einer 2020 veröffentlichten Pilotstudie gemessen.
Das Durchschnittsalter betrug 37,10 Jahre (IQR 14–56,5). Die Verteilung zwischen den Geschlechtern betrug 24/49 (m / w). Es wurden keine statistisch signifikanten Unterschiede zwischen männlichen und weiblichen Serum-Spermidinspiegeln gefunden (männlich: Mittelwert 22,19 ng / ml, IQR 14–29 ng / ml; weiblich: Mittelwert 21,26 ng / ml, IQR 12–27 ng / ml; p = 0,481).
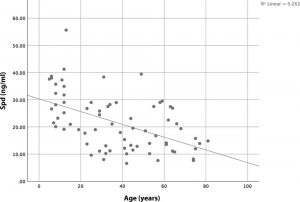
Abb. Bivariate Korrelation zwischen Serum-Spermidinspiegeln und Alter.
Die bivariaten Korrelationsanalysen zeigten eine hoch signifikante negative Korrelation zwischen Serum-Spermidinspiegeln und Alter (p <0,001).
Referenz:
MA Dr. Thomas Pekar, MSc Aribert Wendzel, Dr. Walter Flak, Mag. Alexandra Kremer, Susanne Pauschenwein-Frantsich, BSc Anna Gschaider, Univ. Doz. Dr. Felix Wantke, Univ. Prof. Dr. Reinhart Jarisch. Spermidine in dementia Relation to age and memory performance. Wiener klinische Wochenschrift > Ausgabe 1-2/2020
Referenzen:
Metcalf DJ, García-Arencibia M, Hochfeld WE, Rubinsztein DC. Autophagy and misfolded proteins in neurodegeneration. Exp Neurol. 2012;238(1):22–28.
Sperling RA, Donohue MC, Raman R. et al. Assoziation von Faktoren mit erhöhter Amyloidbelastung bei klinisch normalen älteren Personen. JAMA Neurol. 2020; 77 (6): 735–745. doi: 10.1001 / jamaneurol.2020.0387
Ihr Eduard Rappold
Alles was Sie über Ademetionin wissen sollten
Vom Spezialisten für Angewandte Epigenetik und Gesundheitsvorsorge – NUGENIS

https://nugenis.eu/shop/
Verzehrsempfehlung
Ein gestrichener Messlöffel Soyup-Spermidine-Pulver mit mindestens 200 ml Wasser verrühren. Die Wassermenge kann auf Wunsch erhöht werden.
Soyup-Spermidine-Pulver kann auch in Frischkäse, Joghurt, Milch, Fruchtsäfte untergerührt werden.
Da der Spermidingehalt mit dem Alter abnimmt, wird Spermidin
spätesten ab dem 40. Lebensjahr substitutionspflichtig (4 mg% Spermidin entspricht 2 -3 Messlöffel pro Tag).
Um das 80. Lebensjahr sollten 8 mg% Spermidin (4 Messlöffel) pro Tag ergänzt werden.
1 Messlöffel entspricht > 1,7mg Spermidin.
