Mitochondrien entscheiden über unsere Gesundheit
Mitochondrien entscheiden über unsere Gesundheit
Wenn Sie noch nie von Mitochondrien gehört haben, gehören Sie zur Mehrzahl der Leser. Dennoch ist es für Sie wichtig, über das Schicksal ihrer Mitochondrien Bescheid zu wissen. Denn, geht es ihren Mitochondrien gut, dann ist ihre Gesundheit gesichert. Es gibt darüber hinaus eine gute Nachricht diese Zielsetzung zu erreichen. Gerade in jenem Lebensabschnitt in dem Sie sich besonders leistungsfähig fühlen und Sie all ihre Kräfte der Familie, dem Beruf und ihrer Karriere widmen, im Alter um die 40, beginnt das Drama der inneren Zellzerstörung. Sport-, Wellness- und Fitnessangebote können Ihnen bei Alterung und der Entwicklung der typischen Alterskrankheiten im Eigentlichen nicht helfen. Sie können aber den zu diesem Zeitpunkt einsetzenden Produktionsmangel eines körpereigenen Moleküls, das in seiner Wichtigkeit an zweiter Stelle nach ATP steht, ersetzen und ihrem Körper helfen gesund zu bleiben.
Es entscheiden Anzahl und Vitalität der Mitochondrien in unseren Zellen über die Gesundheit der Zelle, der Organe und somit über unsere Gesundheit.
Mitochondrien finden sich im Zytoplasma, das ist der gesamte lebende Inhalt einer Zelle, einer jeden Körperzelle, mit Ausnahme der roten Blutkörperchen.
Der menschliche Körper hat 130 Billionen Zellen. In jeder dieser Zellen finden sich mehrere hundert Mitochondrien. In jeder Gehirnzelle, Herzmuskel- und Skelettmuskelzelle sind sogar bis zu 1000 Mitochondrien und in der sehr stoffwechselaktiven Leberzelle sind bis zu 5000 Mitochondrien enthalten.
Mitochondrien sind die entscheidende evolutionäre Revolution für unseren Organismus
Energie stand plötzlich im Überfluss zur Verfügung und das Lebewesen schwelgte im Luxus seiner strategischen biologischen Möglichkeiten. Das Gehirn konnte seine heutige Komplexität erhalten, Skelettmuskulatur war ausreichend vorhanden, um schnelle Beute zu machen, aber vor allem sich einer drohenden Lebensgefahr lebensrettend zu entziehen und unser leistungsfähigstes Organ, die Leber, kann dem Organismus mit seinen komplexen Stoffwechselaufgaben bestens dienlich sein.
Mitochondrien sind die Kraftwerke der Zellen
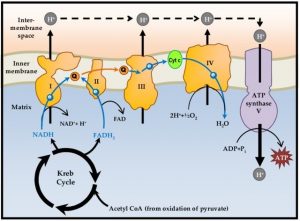
Abb. schematische Darstellung des mitochondrialen oxidativen Phosphorylierungs- Systems als Atmungskette bekannt
Eine Reihe hintereinander geschalteter Elektronenüberträger (Flavoproteine, FeS-Zentren, Ubichinon und Cytochrome) transferiert die Elektronen von NADH oder FADH2 auf O2. Mit der dabei freigesetzten Energie werden H+-Ionen aus der Matrix in den Intermembranalraum der Mitochondrien gepumpt: Die H+-Konzentration außerhalb der inneren Membran wird höher als innerhalb, der Matrix des Mitochondriums. Das Zurückfließen von H+ in der Richtung des Konzentrationsgefälles ist gekoppelt mit der Synthese von ATP durch die ATP-Synthase an der inneren Mitochondrienmembran (OXPHOS -oxidative Phosphorylierung), uns als Atmungskette bekannt.
Adenosintriphosphat (ATP) ist die Energie des Lebens
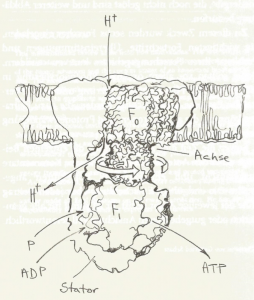
Die ATP-Synthase ermöglicht die Herstellung von Energie in Form von Adenosintriphosphat (ATP) aus protonengetriebenen F1.F0-Turbinen.
Abb. Aufbau und Wirkungsweise der protonengetriebenen F1.F0-Turbine.
Die ATP-Ausbeute bei vollständiger Oxidation von Glucose beträgt 30 ATP-Moleküle, davon alleine aus der Atmungskette kommen 28 ATP-Moleküle. Das brachte den energetischen Überfluss und unglaubliche Chancen für die Entwicklung des Organismus, wie wir ihn heute kennen.
Was können die Mitochondrien noch
Neben der Bereitstellung unseres Energiestoffes für das Leben und dass sie die Monoaminoxidasen an der äußeren Mitochondrienmembran tragen, kommen den Mitochondrien andere wichtige Aufgaben zu:
- Der mitochondriale Stoffwechsel steuert die Spiegel der wichtigsten Signalmoleküle wie ATP, Acetyl-CoA, NADH, NAD + und deren Verhältnis zu Ademetionin (S-Adenosylmethionin).
- Die Schrittmacherreaktion der Cortisol-Synthese, da die Synthese des Cortisols im Mitochondrium mit einer Hydroxylierung von Cholesterin zu Pregnolon beginnt.
- Die Mitochondrien haben eine antioxidative Kapazität. Ein Enzym namens Protonen-translozierende Transhydrogenase, das an der inneren Mitochondrienmembran verankert ist, über einen elektrochemischen Protonengradienten, als Teil der Atmungskette, um die Mitochondrien mit genau der richtigen Menge des Co-Enzyms NADPH zu versorgen. NADPH regeneriert die antioxidative Kapazität, um eine übermäßige reaktive Sauerstoffspezies -Emission zu verhindern und ist somit ein.
Die Mitochondrien können ein Selbstzerstörungssystem entwickelten
Die mitochondriale Permeabilitätsübergangspore wird aktiviert, wenn die biochemische Gesundheit der Mitochondrien und Zellen abnimmt, insbesondere wenn die mitochondriale Energieproduktion abnimmt, die ROS-Erzeugung zunimmt und übermäßiges Ca ++ in das Zytosol freigesetzt und vom Mitochondrium aufgenommen wird. Wenn das mitochondriale Permeabilitätsübergangspore aktiviert ist, öffnet sie einen Kanal in der mitochondrialen Innenmembran und initiiert den programmierten Zelltod (Apoptose).
Mitochondrien sind mit ihrem Herkommen ein Sonderfall
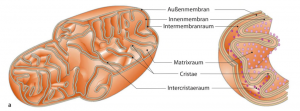
Mitochondrien entstanden vor rund zwei Milliarden Jahren durch die Verschlingung (Endobiose) eines α-Proteobakteriums durch einen Vorläufer der modernen eukaryotischen Zelle und sind somit intrazelluläre Aliens. Mitochondrien bestehen aus zwei getrennten und funktionell unterschiedlich, einer äußeren Membran, die eukaryotische Charakteristika zeigt und einer inneren Membran, die den prokaryotischen Ursprung der Doppelmembran von ihren bakteriellen Vorfahren darstellt.
Die äußere Mitochondrienmembran trägt Monoaminooxidasen vom Subtyp A und B
Monoaminoxidasen (MAOs) wurden von Mary L.C. Hare (später Mary Bernheim) vor fast einem Jahrhundert, im Jahr 1928 erforscht. Die Entdeckung der ersten MAO, ursprünglich Tyraminoxidase genannt, hat den Forschern den Weg geebnet, das Potenzial von MAOs als biologische Angriffspunkte und die Entwicklung von Therapeutika zu untersuchen, die hauptsächlich mit neurologischen Erkrankungen zusammenhingen.
Abb. Struktur eines Mitochondriums
MAO-A und MAO-B finden sich im Gehirn in den Astrozyten und Neuronen, im endoplasmatischen Retikulum, wo die Umschreibung der Erbinformation in die Proteinstruktur erfolgt und in den Lysosomen, die eine wichtige Aufgabe bei der Zellmüllentsorgung haben, aber sie auch außerhalb des Gehirns zu finden.
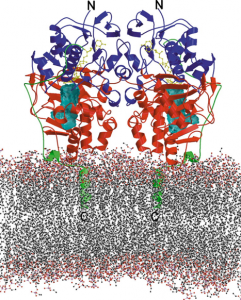
Abb. Dreidimensionale Struktur von humanem Mao B, die an die Phospholipid-Doppelschicht der äußeren mitochondrialen Membran gebunden ist.
Monoaminoxidasen (MAOs) MAO A als auch MAO B sind membranassoziierte Enzyme, die spezifisch an der äußeren Mitochondrienmembran verankert sind., die Monoamine durch oxidative Desaminierung mit Hilfe von H2O und O2 zu den entsprechenden Aldehyden, Ammoniak und Wasserstoffperoxid abbauen.
Monamine sind wichtige Neurotransmitter, Gewebshormone und Hormone wie Serotonin, Melatonin, Noradrenalin und Adrenalin. Sie werden vorwiegend durch die MAO-A abgebaut.
Phenylethylamin und Benzylamin. Sie werden vorwiegend durch die MAO-B abgebaut.
Beide MAO-Typen A und B bauen Dopamin, Tyramin und Tryptamin ab.
Der Anteil der MAOB im Gehirn beträgt 80% der Monoaminooxidasen (MAOs).
ROS (Reaktive Sauerstoffspezies) und RNS (Reaktive Stickstoffspezies)
Die Mitochondrien gelten als wichtige Quelle der zellulären ROS- (Reaktive Sauerstoffspezies) – Produktion. Schon unter physiologischen Bedingungen entstehen in den Mitochondrien aus 0,2-4% des verstoffwechselten Sauerstoffs zytotoxische Verbindungen (reactive oxygen species, ROS).
Ein Großteil der reaktiven Verbindungen wird an den Atmungskettenkomplexen I und III als Superoxid-Anion in die mitochondriale Matrix und über Komplex III zusätzlich in den Intermembranraum abgegeben, sodass die O2 • – Konzentration intramitochondrial etwa fünf- bis zehnfach höher ist, als im Zytosol (flüssiger Bestandteil des Zytoplasmas ) der Zellen.
Die mitochondriale DNA liegt frei in der Matrix der Mitochondrien und ist im Gegensatz zu der nukleären DNA weder durch einen Kern noch durch Histone geschützt. Durch die räumliche Nähe zu den an der inneren Mitochondrienmembran produzierten ROS ist sie dadurch besonders anfällig für oxidative Schäden. Da die mitochondriale DNA für einige mitochondriale Proteine, wie beispielsweise für Bestandteile der Atmungskette, codiert, können sich Schäden am mitochondrialen Erbgut direkt auf die Funktionalität des Mitochondriums und dadurch auch auf die ROS-Produktion auswirken.
Meist handelt es sich dabei um freie Radikale, wie am oben angeführten Beispiel: O2 •, also Atome oder Moleküle, die ein oder mehrere ungepaarte Elektronen besitzen und deswegen danach streben, mit anderen chemischen Verbindungen zu reagieren und Elektronen aufzunehmen, wodurch sie reduziert und letztere oxidiert werden. Andere ROS verfügen über stabile Elektronenkonfigurationen und sind somit keine Radikale im engeren Sinne, weisen aber ebenfalls oxidierende Eigenschaften auf und werden genauso zu den reaktiven Verbindungen gezählt.
All diesen ROS (Reaktive Sauerstoffspezies) und RNS (Reaktive Stickstoffspezies) ist gemeinsam, dass sie durch Oxidationsprozesse an zellulären Makromolekülen wie Lipiden, Proteinen oder Nukleinsäuren Zellschäden hervorrufen können und dadurch die Integrität und Funktionalität der Zelle gefährden.
Die mitochondriale Theorie von Altern und Neurodegeneration (Harman 1972) postuliert einen molekularen Teufelskreis, in dem sich oxidativer Zellstress und Schäden an mitochondrialen Proteinen und mitochondrialer DNA gegenseitig verstärken.
Mitochondriale Dysfunktion ist ein sehr frühes Ereignis
Hier liegt der Ursprung aller mitochondrialen Funktionsstörungen. Mitochondriale Dysfunktion ist ein sehr frühes Ereignis bei Altern und bei vielen neurodegenerativen Erkrankungen, wie Huntington-, Parkinson- und Alzheimer- Krankheit, Amyotrophe Lateralsklerose, Schlaganfall und Epilepsie. Zudem liefern Untersuchungen in den letzten Jahren auch Hinweise für eine Fehlfunktion der Mitochondrien bei psychiatrischen Erkrankungen, wie z.B. Bipolarer Störung und Depression. Es findet sich auch potenzielle Überschneidung zwischen psychiatrischen Störungen und Stoffwechselstörungen, wie dem Diabetes mellitus.
Der Anstieg der Monoaminoxidase– Expression hat dekonstruktive Kompetenz
Eine erhöhte MAOB-Aktivität belastet das Mitochondrium selbst und die Zellen mit toxischen Endprodukten aus der oxidativen Desaminierung beim Abbau von Monaminen.
Eine erhöhte MAOB-Expression findet sich im Alter, hier ist die MAOB auf das 3 bis 4-fache erhöht, bei der Alzheimerkrankheit mit spätem Beginn (80% der Demenzen), bei toxischem Stress, Burnout und Depressionen, bei Rauchern, Alkoholabusus, Protonenpumpen-Hemmer – (PPI) – Langzeiteinnahme und einer Langzeitcortisontherapie.
Abb. Überexpression von MAO-B bei Patienten mit schwerer depressiver Störung
Bei den Protonenpumpenhemmer – Proton-Pump-Inhibitors (PPIs) – Omeprazol, Esomeprazol, Lansoprazol, Dexlansoprazol, Rabeprazol, Pantoprazol, Dexrabeprazol, Ilaprazol besteht ein direkter Zusammenhang zwischen dem Auftreten von Delir, Demenz und Depression einerseits und dem langfristigen Einsatz von PPI andererseits.
PPIs galten lange Zeit als absolut unbedenkliche Arzneistoffe für den kurz- und langfristigen Gebrauch. Studien weisen darauf hin, dass ein Zusammenhang mit Alzheimer Demenz, Depression und Delir bei langfristigem Einsatz von PPIs vorkommt.
MAOB und die Metabolisierung des Neurotransmitters Dopamin
Ein wichtiger Akteur für den dopaminergen Neuronenverlust, ist der Dopamin-Stoffwechsel selbst, der als eine Hauptquelle der intrazelluläre reaktive Sauerstoffspezies- Produktion gilt.
Dopamin wird überwiegend durch MaoB oxidativ desaminiert.
Oxidative Desamination durch MaoB produziert Hydrogen-Peroxid und das reaktive 3,4-Dihydroxyphenylacetaldehyd (DOPAL).
Eine Untermethylierung der Erbsubstanz führt zu erhöhter MAOB-Expression
Die Innenseite der äußeren Mitochondrienmembran, die eukaryotischen Ursprungs ist, verankert die Monoaminooxidasen, die bei übermäßiger Expression das Potential der Produktion reaktiver Sauerstoff- und Stickstoffspezies haben und zum Untergang der Mitochondrien und in Folge auch zum Verlust der Neurone und Gliazellen führen. Den Untergang der Nervenzellen im Gehirn nennen wir Neurodegeneration.
Die Ursache für die verstärkte Expression (Bildung) von MAOB ist die Untermethylierung (Fehlen der Methyl-Gruppen als Marker an der Erbsubstanz) des Genortes der MAOB.
Mit zunehmendem Alter ist die Untermethylierung der Erbsubstanz die Regel, da die körpereigene Ademetionin-Produktion in unseren Leberzellen vermindert wird.
Auch bei der Alzheimerkrankheit vom späten Beginn (80% der Demenzen), bei toxischem Stress, Burnout und Depressionen, bei Rauchern, Alkoholabusus, PPI-Langzeiteinnahme und einer Langzeitcortisontherapie kommt es zur Untermethylierung der Erbsubstanz und dadurch zur verstärkten MAOB-Expression mit ihren zytotoxischen und gliatoxischen Folgen beim Abbau der monaminergen Neurotransmitter.
Die Untermethylierung der Gene führt zu Expression von „Altersproteine“/“Enhancer“. Als Beispiel bei der Entstehung der Alzheimer-Krankheit mit der vermehrten Expression von DSCAML1 – , BACE1 – , PSEN1 – und MAOB – Genen, die ursächlich für die Amyloid- und Tau-Pathologie sind.
Die Limitationen unserer Gesundheit
So wird eine verminderten Adenosin-5′-triphosphat (ATP) -Produktion durch die Mitochondrienschädigung und eine erhöhte Produktion reaktiver Sauerstoff- und Stickstoffspezies (RONS) durch die erhöhte Expression von MAOB- Gen bei Untermethylierung ihres Genortes, bei einem erworbenen Ademetioninmangel, mit eine Ursache für vorzeitiges Altern und die Ursache für neurodegenerativen Erkrankungen, beispielsweise wie der Alzheimer Krankheit, von psychiatrischen Störungen, wie Depressionen und von Stoffwechselstörungen, wie dem Diabetes mellitus.
Gibt es Hilfe?
Die Lösung des Problems ist die Substitution von Ademetionin, da Ademetionin der einzige Methylgruppen-Donator für unsere Erbsubstanz ist und so die Untermethylierung der Erbsubstanz aufhebt.

Abb. Ademetionin wird in einer präventiven Dosis von 400 mg verabreicht. NUGENIS
Warum ist Vorsorge so wichtig?
Vorsorge (Prävention) ist darum notwendig, weil die zellzerstörende Wirkung der „Altersproteine“/“Enhancer“ diagnostisch nicht früh genug erkannt werden kann und bei den ersten klinischen Zeichen bereits massive Organschäden vorliegen („stumme Phase“ der „Alters“krankheiten).
Als Beispiele: bei der Alzheimer Krankheit vom späten Beginn sind bei Erstdiagnose bereits 40% der Synapsenkontakte verloren gegengegangen oder bei der Parkinsonkrankheit liegen die ersten klinischen Zeichen erst nach dem Untergang von 70% der dopaminergen Neurone im Stammhirn vor.
Ohne Vorsorge sind ausschließlich symptomatische Therapieansätze möglich und schlussendlich die Pflege des Kranken notwendig.
Darum ist eine rechtzeitige Vorsorge und die regelmäßige Einnahme von Ademetionin zur Vermeidung von irreparablen Schäden durch den Fortbestand einer Hypomethylierung bei Ademetioninmangel für jeden von uns so wichtig.
Was ist Ademetionin (S-Adenosylmethionin)?
Ademetionin ist ein epigenetisch wirksames Molekül und wird vorwiegend in den Leberzellen gebildet.
S-Adenosylmethionin ist nach ATP das zweitwichtigste Signalmolekül im menschlichen Organismus.
S-Adenosylmethionin ist der Spender für Methylgruppen bei der Transmethylierung für die nukleärer DNA, mitochondrialer DNA und das Chromatin.
Die Methylierung der DNA (Erbsubstanz) ist ein natürlich vorkommender autochthoner metabolischer Prozess im Organismus.
S-Adenosylmethionin geht mit seiner Wirkung nie darüber hinaus, die ein natürlich vorkommender autochthoner metabolischer Prozess im Organismus haben kann.
Ganz im Gegensatz dazu: Ein Medikament überschreitet immer die Erheblichkeitsschwelle, die über die Wirkung hinausgeht, die ein natürlich vorkommender autochthoner metabolischer Prozess im Organismus hat.
S-Adenosylmethionin hat eine physiologische Wirkung und unterstützt Stoffwechselprozesse auf natürliche Weise.
S-Adenosylmethionin kann eine Hypomethylierung, die altersabhängig und selbst- und mitverursacht auftritt, präventiv verhindern.
S-Adenosylmethionin in präventiver Dosis schließt bei gleichzeitiger Gabe von Cobalamin, Folat und B6 (Pyridoxin, Pyridoxal und Pyridoxamin) eine Hyperhomozysteinämie aus.
Literatur Alles was Sie über Ademetionin wissen sollten

Abb. Ademetionin 400 mg/Kapsel ist in allen epigenetisch wirksamen Produkten von NUGENIS.
Ihr Eduard Rappold