S-Adenosylmethionin (SAM, Ademetionin)-Supplementation zum Schutz des Mitochondriums bei mitochondrialer Dysfunktion
Mitochondrium Morphologie: Struktur und Anpassungen
Mitochondrien sind hochdynamische Zellorganellen, die in Größe, Form und innerer Struktur variieren können – je nach Zelltyp, Stoffwechselanforderungen und Umgebung. Ihre Morphologie ist entscheidend für ihre Funktion als Energieproduzenten (ATP-Synthese), Signalgeber und Regulatoren des Zellstoffwechsels.
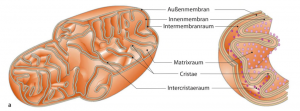
Mitochondrien besitzen eine Doppelmembran, die verschiedene funktionelle Bereiche abgrenzt:
🔹 Äußere Membran
- Enthält Porine (Proteinkanäle), die Moleküle bis ca. 5 kDa durchlassen.
- Ist relativ durchlässig für Metaboliten.
- Enthält Enzyme für Lipid-Synthese und den Import von Proteinen.
🔹 Intermembranraum
- Enthält Enzyme für oxidative Phosphorylierung (z. B. Cytochrom c).
- Ist ein wichtiger Bereich für Apoptose-Signalwege.
🔹 Innere Membran
- Stark gefaltet (→ Cristae), um die Oberfläche für die ATP-Synthese zu vergrößern.
- Enthält die Elektronentransportkette (Atmungskette) und die ATP-Synthase.
- Sehr selektiv permeabel – reguliert den Transport von Metaboliten durch spezielle Transporter.
🔹 Matrix
- Enthält mitochondriale DNA (mtDNA), Ribosomen und Enzyme für den Zitratzyklus und β-Oxidation.
- Ist der Hauptort für oxidativen Stoffwechsel.
Mitochondrien sind keine starren Organellen, sondern dynamische Netzwerke, die durch Fusion und Fission reguliert werden.
Störungen in der Fusion/Fission-Dynamik sind mit neurodegenerativen Erkrankungen (z. B. Parkinson, Alzheimer) und metabolischen Störungen (z. B. Diabetes) verbunden.
Pathologische Veränderungen der Morphologie
Ein gestörter mitochondrialer Aufbau kann zu verschiedenen Erkrankungen führen:
> Geschwollene Mitochondrien → Zeichen für oxidativen Stress oder Zellschädigung (z. B. bei Ischämie oder Toxinen).
> Fragmentierte Mitochondrien → können in neurodegenerativen Krankheiten auftreten.
> Veränderte Cristae-Struktur → beobachtet bei Krebszellen, da sie Energie anders produzieren (Warburg-Effekt).
> Mangel an Fusion → verbunden mit Muskelerkrankungen und mitochondrialen Myopathien.
Mitochondriale Dysfunktion
Eine mitochondriale Dysfunktion tritt auf, wenn Mitochondrien nicht mehr effizient arbeiten, was zu Energieverlust, oxidativem Stress und Zellschäden führt.
S-Adenosylmethionin (SAM, Ademetionin) ist ein essenzieller Schutzmechanismus gegen mitochondriale Dysfunktion & Alterung.
Folgen der mitochondrialen Dysfunktion:
Mitochondrien sind für viele Zellprozesse verantwortlich – ihre Dysfunktion kann deshalb fast jede Zelle betreffen.
> Neurodegenerative Erkrankungen (Alzheimer, Parkinson, ALS)
- Gehirn braucht viel ATP – wenn Mitochondrien versagen, sterben Nervenzellen ab.
- Zu viel ROS → Ablagerung von fehlgefalteten Proteinen (z. B. Beta-Amyloid in Alzheimer).
- Gestörte Fusion/Fission → Neuronen können keine gesunden Mitochondrien regenerieren.
> Kardiovaskuläre Erkrankungen (Herzinsuffizienz, Bluthochdruck)
- Herzmuskelzellen haben extrem viele Mitochondrien → Energieverlust führt zu Schwäche.
- Mitochondriale Schädigung → erhöhtes Risiko für Herzinfarkt und Arteriosklerose.
> Muskelerkrankungen & Müdigkeit
- Myopathien: Muskelschwäche, Krämpfe und schnelle Erschöpfung.
- Chronisches Fatigue-Syndrom (CFS) wird mit gestörter ATP-Produktion in Verbindung gebracht.
> Krebs
- Krebszellen nutzen oft eine alternative Energiequelle (Warburg-Effekt → mehr Glykolyse, weniger oxidative Phosphorylierung).
- Mutierte Mitochondrien können das Zellwachstum unkontrolliert fördern.
> Metabolische Erkrankungen (Diabetes, Fettleber)
- Insulinresistenz ist mit einer mitochondrialen Dysfunktion verbunden.
- Defekte Mitochondrien können keine Fettsäuren richtig verbrennen → Fett lagert sich in Leber & Muskeln ab.
S-Adenosylmethionin (SAM, Ademetionin) zum Schutz vor oxidativem Stress (ROS) und zur Sicherung der mitochondrialen Gesundheit
S-Adenosylmethionin (SAM, Ademetionin) ist ein zentraler Metabolit im Zellstoffwechsel und spielt eine entscheidende Rolle im Methylierungskreislauf, der antioxidativen Abwehr und der mitochondrialen Funktion.
Der menschliche Körper produziert täglich etwa 6–8 Gramm SAM (S-Adenosylmethionin).
Diese Menge ist notwendig, um zahlreiche Methylierungsreaktionen aufrechtzuerhalten, die essenziell für DNA, Proteine, Neurotransmitter, Zellmembranen und Entgiftungsprozesse sind.
Besonders wichtig ist S-Adenosylmethionin (SAM. Ademetionin) als Schutz vor reaktiven Sauerstoffspezies (ROS), die Mitochondrien schädigen und zur mitochondrialen Dysfunktion beitragen.
Was ist S-Adenosylmethionin (SAM, Ademetionin) und wie wird es gebildet?
SAM ist ein universeller Methylgruppen-Donor und wird aus Methionin (einer essenziellen Aminosäure) und ATP ( Methionin-Zyklus oder Kohlenstoff-1 – Zyklus) gebildet.
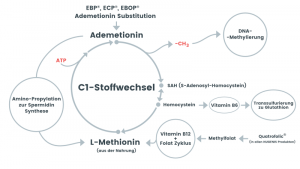
Der Prozess erfolgt durch das Enzym Methionin-Adenosyltransferase (MAT) in den Mitochondrien und im Cytosol.
S-Adenosylmethionin (SAM, Ademetionin) ist notwendig für:
> Methylierung von DNA, RNA, Proteinen & Phospholipiden
> Synthese von Neurotransmittern (Serotonin, Dopamin, Adrenalin)
> Entgiftung von Homocystein (Methionin-Zyklus)
> Produktion von Glutathion – dem stärksten intrazellulären Antioxidans
> Regulation der mitochondrialen Biogenese & Funktion
Wie schützt S-Adenosylmethionin (SAM, Ademetionin) vor oxidativem Stress (ROS)?
S-Adenosylmethionin (SAM, Ademetionin) fördert die Synthese von Glutathion (GSH), dem stärksten Antioxidans in den Mitochondrien.
Glutathion muss also direkt in jeder Zelle gebildet werden – es kann nicht durch Nahrung oder Transport aus dem Blut ersetzt werden.
➡ Glutathion (GSH) entgiftet ROS und schützt Zellen vor oxidativen Schäden.
➡ Ein niedriger GSH-Spiegel ist ein Marker für Zellalterung und mitochondriale Dysfunktion.
➡ S-Adenosylmethionin (SAM, Ademetionin) steuert über die Transsulfuration den Schwefelstoffwechsel zur GSH-Produktion. GSH kann in oxidierter Form (GSSG) vorliegen, wird aber durch Glutathion-Reduktase (GR) regeneriert.
S-Adenosylmethionin (SAM, Ademetionin) und oxidative Schutzmechanismen
> Methylierung von antioxidativen Enzymen (SOD, Katalase, Glutathion-Peroxidase).
> Regulation der Elektronentransportkette → reduziert Leckagen von ROS in den Mitochondrien.
> Stabilisierung der mitochondrialen Membran → verhindert Schäden durch Lipidperoxidation.
➡ Ohne ausreichendes S-Adenosylmethionin (SAM, Ademetionin) kann die Zelle weniger Glutathion herstellen, was zu erhöhter ROS-Belastung und mitochondrialer Dysfunktion führt.
Zusammenhang zwischen S-Adenosylmethionin (SAM, Ademetionin), mitochondrialer Dysfunktion & Krankheiten
Ein niedriger SAM-Spiegel wird mit vielen Erkrankungen in Verbindung gebracht, die durch oxidativen Stress und mitochondriale Dysfunktion verursacht werden:
🔹 Neurodegenerative Erkrankungen (Alzheimer, Parkinson, ALS)
➡ Niedrige S-Adenosylmethionin (SAM, Ademetionin) -Werte führen zu gestörter Methylierung von Neurotransmittern & Membranproteinen.
➡ Erhöhte ROS-Schäden in Nervenzellen → beschleunigte Degeneration.
🔹 Lebererkrankungen (Fettleber, Leberzirrhose)
➡ S-Adenosylmethionin (SAM, Ademetionin) reguliert die Lipidoxidation & schützt vor oxidativen Schäden.
➡ bei der Leberzirrhose ist S-Adenosylmethionin (SAM, Ademetionin) reduziert, wodurch sich oxidative Schäden verstärken.
🔹 Herz-Kreislauf-Erkrankungen (Arteriosklerose, Bluthochdruck)
➡ Oxidativer Stress führt zu Endothelschäden – S-Adenosylmethionin (SAM, Ademetionin) schützt durch Methylierung von Schutzproteinen.
🔹 Depression & psychische Erkrankungen
➡ S-Adenosylmethionin (SAM, Ademetionin) -Mangel beeinträchtigt die Serotonin- und Dopaminproduktion.
➡ Studien zeigen, dass S-Adenosylmethionin (SAM, Ademetionin) als natürliches Antidepressivum wirkt.
Wie kann man optimieren, um Mitochondrien zu schützen?
S-Adenosylmethionin (SAM, Ademetionin) wird nicht langfristig im Körper gespeichert, sondern kontinuierlich produziert und abgebaut, je nach Bedarf der Zellen.
S-Adenosylmethionin (SAM, Ademetionin) ist sehr instabil und zerfällt beim Lagern, Erhitzen oder Verarbeiten schnell.
Tierische Produkte enthalten S-Adenosylmethionin (SAM, Ademetionin) , aber in zu geringen Mengen, um eine direkte Wirkung zu haben.
S-Adenosylmethionin (SAM, Ademetionin) wurde in geringen Mengen in folgenden Lebensmitteln nachgewiesen:
| Lebensmittel | Ungefähre SAM-Konzentration |
|---|---|
| Fleisch (v. a. Rind, Schwein, Huhn) | Niedrig (< 5 mg/100 g) |
| Fisch (Lachs, Thunfisch, Makrele) | Sehr niedrig (< 2 mg/100 g) |
| Eier | Spuren von SAM (< 1 mg/100 g) |
| Milchprodukte | Kaum messbar (< 0,5 mg/100 g) |
| Grünes Gemüse (Brokkoli, Spinat) | Minimal vorhanden (< 0,1 mg/100 g) |
SAM kommt in geringen Mengen natürlich in einigen Lebensmitteln vor, aber es ist extrem instabil und zerfällt schnell. Daher wird es kaum in relevanten Mengen über die Nahrung aufgenommen.
Nahrungsergänzung ist die optimale Form der
- S-Adenosylmethionin (SAM, Ademetionin) -Supplementation: empfohlene Dosis: 400 mg (präventive Dosis) – 1600 mg (therapeutische Dosis).
- B-Vitamine (B6, B9, B12) → essentiell für die S-Adenosylmethionin (SAM, Ademetionin) -Regeneration im Methionin-Zyklus.
Direkter Risikofaktor für mitochondriale Dysfunktion
Der enge räumliche Nähe zwischen Monoaminoxidase (MAO) an der äußeren Mitochondrienmembran und der Atmungskette an der inneren Membran ist ein zentraler Faktor für mitochondriale Dysfunktion.
Der mitochondriale intermembranöse Spalt (IMS) ist der Raum zwischen der äußeren und inneren Membran der Mitochondrien. Seine Breite liegt im Bereich von 10 bis 20 Nanometern (nm).
- Enthält proteingelöste Moleküle, die am Zellstoffwechsel beteiligt sind (z. B. Cytochrom c für die Atmungskette).
- Ist chemisch ähnlich zum Zytosol, da die äußere Membran durch Porine relativ durchlässig für kleine Moleküle ist.
Hier sind einige entscheidende Punkte dazu:
-
ROS-Produktion durch MAO:
- MAO katalysiert die oxidative Desaminierung von biogenen Aminen (z. B. Dopamin, Serotonin, Noradrenalin).
- Dabei entsteht Wasserstoffperoxid (H₂O₂), das leicht in Hydroxylradikale umgewandelt werden kann – besonders in der Nähe von Eisen-Ionen (Fenton-Reaktion).
-
Diffusion von ROS in den Intermembranraum:
- Da der intermembranöse Spalt nur wenige Nanometer breit ist, können die reaktiven Sauerstoffspezies (ROS) sehr leicht zur inneren Mitochondrienmembran diffundieren.
- Das bedeutet, dass die MAO-abhängige ROS-Produktion direkt die Komponenten der Atmungskette (z. B. Komplex I und III) angreifen kann. Die Atmungskette besteht aus vier großen Proteinkomplexen und einem ATP-Synthase-Enzym.
-
Feedback-Schleife der Schädigung:
- Durch oxidativen Stress kommt es zur Lipidperoxidation der inneren Membran, was deren Fluidität und Proteinintegrität beeinträchtigt.
- Eine geschädigte Atmungskette produziert selbst vermehrt ROS (vor allem Komplex I und III).
- Dies führt zu einer selbstverstärkenden Dysfunktion der Mitochondrien.
-
Beeinträchtigung der mitochondrialen Biogenese und Dynamik:
- ROS beeinflussen die Fusion-Fission-Dynamik der Mitochondrien (z. B. durch Oxidation von Mitofusin- oder OPA1-Proteinen).
- Dies kann zu einer Fragmentierung der Mitochondrien führen, die mit neurodegenerativen Erkrankungen wie Morbus Parkinson oder Alzheimer assoziiert ist.
Die enge Nachbarschaft zwischen MAO an der äußeren Membran und der Atmungskette an der inneren Membran macht den MAO-abhängigen ROS-Boost zu einem direkten Risikofaktor für mitochondriale Dysfunktion. Dies ist besonders relevant in Zellen mit hohem Energiebedarf und hoher Neurotransmitteraktivität, wie Neuronen oder Kardiomyozyten.
Mitochondriale Dysfunktion ist multifaktoriell bedingt, weshalb weitere Faktoren wie antioxidative Kapazität, NAD+-Verfügbarkeit und die Funktion der mitochondrialen Biogenese berücksichtigt werden müssen.
Primäre Prävention der mitochondrialen Dysfunktion durch MAO Expression -Stillegung durch S-Adenosylmethionin (SAM, Ademetionin)
S-Adenosylmethionin (SAM, Ademetionin) als Regulator der MAO-Expression
- S-Adenosylmethionin (SAM, Ademetionin) hemmt indirekt die MAO-Expression über epigenetische Mechanismen, insbesondere durch DNA- und Histon-Methylierung.
- Eine ausreichende Verfügbarkeit von S-Adenosylmethionin (SAM, Ademetionin) kann somit eine Reduktion der MAO-Expression bewirken, was den oxidativen Stress in den Mitochondrien verringern könnte.
- Infolgedessen kann eine durch S-Adenosylmethionin (SAM, Ademetionin) vermittelte Reduktion der MAO-Aktivität eine Schutzfunktion für die Mitochondrien haben.
Mitochondriale Dysfunktion und präventive Rolle von S-Adenosylmethionin (SAM, Ademetionin)
-
Krankheiten mit erhöhten MAO-Werten
Ein Anstieg der MAO-A oder MAO-B-Aktivität kann verschiedene neurologische und psychiatrische Erkrankungen beeinflussen:
Neurologische Erkrankungen:
-
Parkinson-Krankheit
- MAO-B ist erhöht, was den Abbau von Dopamin beschleunigt → Dopaminmangel verschärft die Symptome.
- MAO-B-Hemmer (z. B. Selegilin, Rasagilin) werden zur Therapie eingesetzt.
-
Alzheimer-Krankheit
- MAO-B-Aktivität ist in Astrozyten erhöht, was oxidativen Stress und Neurodegeneration verstärken kann.
- Erhöhte MAO-B-Level könnten mit Gedächtnisverlust und kognitivem Verfall in Verbindung stehen.
-
Multiple Sklerose (MS)
- Erhöhte MAO-A- und MAO-B-Aktivität im Gehirn wurde mit neuroinflammatorischen Prozessen und der Schädigung der Myelinscheiden in Verbindung gebracht.
Kardiovaskuläre & Stoffwechselerkrankungen:
-
Bluthochdruck (Hypertonie)
- Erhöhte MAO-A-Aktivität kann die Noradrenalin-Konzentration im synaptischen Spalt reduzieren, was zu vaskulären Veränderungen beiträgt.
-
Metabolisches Syndrom & Typ-2-Diabetes
- MAO-A ist in Fettzellen und der Leber erhöht, was mit Insulinresistenz und Entzündungen zusammenhängt.
Psychiatrische Erkrankungen:
-
Depression (Major Depression, atypische Depression)
- Einige Studien zeigen, dass MAO-A bei depressiven Patienten erhöht ist, was zu einem verstärkten Abbau von Serotonin und Noradrenalin führt.
- MAO-A-Hemmer (z. B. Moclobemid) werden als Antidepressiva eingesetzt.
-
Angststörungen & PTBS (Posttraumatische Belastungsstörung)
- Eine erhöhte MAO-A-Aktivität kann zu einem verstärkten Abbau von Dopamin und Serotonin führen → verstärkt Angstreaktionen und Stressverarbeitung.
-
Schizophrenie
- Erhöhte MAO-B-Werte wurden in bestimmten Gehirnregionen nachgewiesen.
- Unklar, ob dies eine Ursache oder eine Folge der Krankheit ist.
Genetische Erkrankungen mit erhöhter MAO-A-Aktivität
- Brunner-Syndrom (X-chromosomale MAO-A-Mutation)
- Mutationen können zu einer Fehlregulation der MAO-A-Aktivität führen.
- Symptome: Aggressivität, impulsives Verhalten, kognitive Defizite.
-
- Durch eine epigenetische Stilllegung der MAO-Expression kann S-Adenosylmethionin (SAM, Ademetionin) als präventive Maßnahme gegen mitochondriale Schäden dienen.
- Zudem ist S-Adenosylmethionin (SAM, Ademetionin) ein essenzieller Cofaktor im Methylstoffwechsel und beeinflusst viele weitere epigenetische Mechanismen, die den mitochondrialen Energiestoffwechsel regulieren.
S-Adenosylmethionin (SAM, Ademetionin) kann durch seine epigenetische Wirkung auf MAO eine primäre Prävention der mitochondrialen Dysfunktion darstellen, indem es den oxidativen Stress reduziert. Allerdings ist dieser Mechanismus nur ein Teil eines komplexen regulatorischen Netzwerks, das auch andere epigenetische und metabolische Faktoren umfasst.
Optimierte S-Adenosylmethionin (SAM, Ademetionin)-Level durch S-Adenosylmethionin (SAM, Ademetionin)-Supplemente können oxidativen Stress reduzieren und die Mitochondrien schützen.
Ihr
Eduard Rappold

SAM-e
S-Adenosylmethionin
400 mg Kapseln (30)
als reines (S/S)-Spiegelbildisomer – 100% biologische Wirkung
https://nugenis.eu/produkt/sam-e/
Eduard Rappold
Dr. Eduard Rappold, MSc ist ein erfahrener Forscher und Arzt, der sich seit Jahrzehnten für geriatrische PatientInnen einsetzt. In seinem Bemühen für Alzheimer-Erkrankte eine immer bessere Versorgung zu ermöglichen, wurde er 2003 mit dem Gesundheitspreis der Stadt Wien für das Ernährungszustandsmonitoring von Alzheimer-Kranken ausgezeichnet. Im Zuge seines Masterstudiums der Geriatrie hat er seine Entwicklung des Epigenetic Brain Protector wissenschaftlich fundiert und empirisch überprüft. Im September 2015 gründete er NUGENIS, ein Unternehmen, mit dem er Wissenschaft und Anwendung zusammenbringen möchte. Damit können Menschen unmittelbar von den Ergebnissen der Angewandten Epigenetik für ihre Gesundheit profitieren. Mit dem Epigenetic Brain Protector hat Dr. Eduard Rappold, MSc bereits für internationales Aufsehen gesorgt – auf der international wichtigsten Innovationsmesse, der iENA, wurde er 2015 mit einer Goldmedaille für hervorragende Leistungen zum Schutz vor Neurodegeneration ausgezeichnet. Auf den Webseiten nugenis.eu, epigenetik.at, spermidine-soyup.com und facebook.com/nugenis können Themen zur Epigenetik und Aktuelles nachgelesen werden.
