
Sensorik im Alter und epigenetischer Einfluss: Mechanismen, Veränderungen und Regulation
Mit zunehmendem Alter kommt es zu einer Abnahme der sensorischen Fähigkeiten in verschiedenen Bereichen wie Sehen, Hören, Tastsinn, Geruch und Geschmack. Neben genetischen Faktoren spielen auch epigenetische Mechanismen eine wesentliche Rolle bei der altersbedingten sensorischen Degeneration. Diese Mechanismen können durch Umweltfaktoren, Lebensstil und Stress beeinflusst werden.
1. Sensorische Veränderungen im Alter
a) Sehen (Visuelle Wahrnehmung)
- Makula-Degeneration (AMD): Epigenetische Dysregulationen in VEGF-Genen (vascular endothelial growth factor) können zur degenerativen Veränderung der Netzhaut beitragen.
ALTERSBEDINGTE MAKULADEGENERATION (AMD)
An der Pathogenese der altersbedingten Makuladegeneration ist die DNA-Hypomethylierung beteiligt.
Die altersbedingte Makuladegeneration (AMD) ist die häufigste Ursache für eine irreversible Blindheit bei Menschen ab 50 Jahren und kann nicht wirksam geheilt werden. Die Krankheit ist gekennzeichnet durch die fokale Ablagerung von azellulären und polymorphen Trümmern, Drusen genannt, zwischen retinalem Pigmentepithel (RPE) und Bruch-Membran.
Eines der in Drusen akkumulierten Hauptproteine ist Clusterin, dessen Expression durch Promotor-Methylierung reguliert wird. Auch gibt es zahlreiche Hinweise, dass die durch oxidativen Stress aus der Atmungskette der Mitochondrien verursachten Störungen eine weitaus größere Bedeutung bei der Entstehung der AMD haben als bislang angenommen. Gerade der oxidative Stress (ROS) führt bei AMD-Patienten zu gravierenden DNA-Schäden der mitochondrialen DNA. Sowohl Alter als auch Rauchen sind bestätigte Risikofaktoren für AMD.
- Katarakt (Grauer Star): Oxidativer Stress und Histon-Modifikationen beeinflussen die Transparenz der Augenlinse.
- Reduzierte Kontrastwahrnehmung: Altersbedingte DNA-Methylierung im OPN1LW-Gen (Farbrezeptor) kann die Farbwahrnehmung reduzieren.
b) Hören (Auditive Wahrnehmung)
- Presbyakusis (Altersschwerhörigkeit):
- Epigenetische Veränderungen in SOD2-Genen (Superoxiddismutase) führen zu einer erhöhten Anfälligkeit für oxidativen Stress in den Haarzellen der Cochlea.
- Methylierung des KCNQ4-Gens (Kaliumkanal) kann zur Degeneration der Hörzellen beitragen.
c) Tastsinn und Schmerzempfindlichkeit
- Reduktion mechanosensitiver Rezeptoren (Meissner-Körperchen, Merkel-Zellen) durch Histon-Methylierung an NGF-assoziierten Genen (Nerve Growth Factor).
- Veränderte Schmerzempfindung:
- Hyper- oder Hypoalgesie (erhöhte oder verminderte Schmerzempfindlichkeit) durch epigenetische Modifikationen in TRPV1 (Schmerzrezeptor).
- In der Hypophyse wird ein Makromolekül aufgeteilt, wodurch im Anschluss Adrenocorticotrophes Hormon ACTH und Betaendorphin zur Verfügung stehen. Immer dann, wenn ein Molekül ACTH entsteht, entsteht chemisch zwingend auch ein Molekül Betaendorphin. Endorphine beruhigen das PANIC/Grief- System (Schmerz und Depression)
d) Geruch und Geschmack
- Geruchsverlust (Hyposmie/Anosmie):
- Methylierung des OR2A1-Gens kann die Reduktion der Riechrezeptoren im Alter beeinflussen.
- Veränderter Geschmackssinn:
- Histon-Acetylierung in gustatorischen Signalwegen kann die Wahrnehmung von Süßem oder Salzigem reduzieren.
2. Epigenetische Mechanismen und Sensorik im Alter
a) DNA-Methylierung
- Altersabhängige Hypermethylierung in sensorischen Genen führt zur reduzierten Expression von Rezeptorproteinen.
- Beispiele:
- Hypermethylierung von BDNF (Brain-Derived Neurotrophic Factor) kann sensorische Plastizität im Gehirn einschränken.
- MAO A SIPS (STRESS-INDUCED PREMATURE SENESCENCE) – MONOAMINOOXIDASEN, OXIDATIVER STRESS UND VERÄNDERTE MITOCHONDRIALE DYNAMIK BEI DER HERZALTERUNG:
Mitochondrien sind in dem Seneszenz-Prozess verwickelt, hauptsächlich, weil sie sowohl Quellen als auch Ziele von reaktiven Sauerstoffspezies (ROS) sind.
Stressbedingte vorzeitige Seneszenz in Herzzellen durch erhöhte MAO A führt zu mitochondrialen Schäden, Kardiomyozytentod und Herzinsuffizienz und steuert in Herzzellen zur ROS-Produktion, mitochondrialer Dysfunktion und Mitophagie-Hemmung bei. Zusätzlich beeinträchtigt MAO A-erzeugter oxidativer Stress die Lysosomenfunktion, was zu einer Blockade des autophagischen Flusses führt.
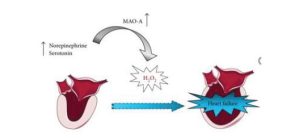
Abb.: ROLLE VON MAO A BEI HERZINSUFFIZIENZ
Quelle: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5435992/figure/fig2/
b) Histon-Modifikationen
- H3K27me3 (Trimethylierung an Histon H3, Lysin 27) ist mit neurodegenerativen Veränderungen und sensorischer Degeneration assoziiert.
- Reduzierte H3K9-Acetylierung führt zu einer schwächeren Synapsenfunktion in sensorischen Bahnen.
c) microRNAs (miRNAs)
- miRNA-183 reduziert die Funktion sensorischer Neuronen bei Hörverlust.
- miRNA-29 ist in alternden Riechzellen überaktiv und hemmt die Regeneration von Geruchsrezeptoren.
3. Einfluss externer Faktoren auf Epigenetik und Sensorik
a) Oxidativer Stress und Ernährung
- Antioxidative Ernährung (Vitamin A, C, E, Polyphenole) kann epigenetische Schäden reduzieren und die Sensorik im Alter erhalten.
- Mangelernährung (Vitamin B12, Zink, Omega-3-Fettsäuren) fördert epigenetische Veränderungen, die Seh-, Hör- und Geschmacksverlust beschleunigen.
- Die Biosynthese von S-Adenosylmethionin (SAM-e, Ademetionin) nimmt bereits im frühen Erwachsenen Alter ab. Eine S-Adenosylmethionin (SAM-e, Ademetionin) ist ratsam, insbesondere wenn es zu epigenetischen Dysregulationen, neurodegenerativen Erkrankungen oder erhöhtem oxidativen Stress kommt.
1. Warum nimmt die SAM-e-Biosynthese im Alter ab?
SAM-e wird in der Zelle aus Methionin und ATP durch das Enzym Methionin-Adenosyltransferase (MAT) synthetisiert. Mehrere Faktoren beeinflussen die SAM-e-Bildung mit zunehmendem Alter:
- Erhöhte oxidative Belastung: Oxidativer Stress kann die Aktivität der Methionin-Zyklenzyme verringern.
- Niedrigere Verfügbarkeit von Vorläufermolekülen: Ein Mangel an Methionin, Vitamin B12, B6 oder Folat reduziert die SAM-e-Synthese.
- Epigenetische Veränderungen: Altersbedingte Veränderungen in der DNA-Methylierung können die Enzymaktivität für die SAM-e-Synthese beeinflussen.
- Dysfunktion des Methionin-Homocystein-Zyklus: Eine Akkumulation von Homocystein, die im Alter häufiger vorkommt, kann die Verfügbarkeit von Methionin für die SAM-e-Synthese senken.
➡ Bereits ab dem frühen Erwachsenenalter kann eine verringerte SAM-e-Produktion nachweisbar sein, was zu epigenetischen Fehlregulationen führt.
2. Ist eine SAM-e-Supplementation ratsam?
Ja, eine Supplementation mit SAM-e kann in verschiedenen Situationen vorteilhaft sein, insbesondere bei:
a) Epigenetische Regulation und Zellgesundheit
- SAM-e ist der wichtigste Methylgruppendonator in der DNA-Methylierung.
- Eine ausreichende Verfügbarkeit ist essenziell für die Regulation von Genexpression, Zellgesundheit und epigenetischer Plastizität.
b) Neuroprotektion und Stimmungsregulation
- SAM-e fördert die Produktion von Neurotransmittern (Dopamin, Serotonin, Noradrenalin) und wird zur Behandlung von Depressionen eingesetzt.
- Studien zeigen, dass SAM-e neuroprotektiv wirken kann und bei Alzheimer, Parkinson und kognitiven Störungen nützlich sein könnte.
c) Lebergesundheit
- SAM-e ist wichtig für Glutathion-Synthese (antioxidatives Schutzsystem der Leber).
- Studien deuten darauf hin, dass eine Supplementation bei Fettlebererkrankungen und Leberzirrhose vorteilhaft sein könnte.
d) Unterstützung der Gelenkgesundheit
- SAM-e zeigt entzündungshemmende und knorpelschützende Eigenschaften und wird bei Arthrose und Gelenkbeschwerden als natürliche Alternative zu NSAIDs verwendet.
b) Chronischer Stress und Hormonveränderungen
- Erhöhte Cortisolspiegel im Alter führen zu einer Hypermethylierung von Stress-assoziierten Genen (NR3C1, FKBP5), was die sensorische Wahrnehmung beeinflusst.
- Beispiel: Dauerstress reduziert die Regeneration sensorischer Neuronen in der Retina und im Innenohr.
c) Umweltgifte und Schadstoffe
- Schwermetalle (Blei, Quecksilber) beeinflussen epigenetische Regulationsmechanismen in sensorischen Neuronen und fördern altersbedingte Degeneration.
- Luftverschmutzung kann durch DNA-Methylierung die Riechzellen schädigen.
4. Möglichkeiten zur epigenetischen Prävention und Therapie
- Ernährungsstrategien zur Förderung epigenetischer Balance ( S-Adenosylmethionin (SAM-e, Ademetionin), Folat, Polyphenole, Omega-3-Fettsäuren).
- Gezieltes Hör-, Seh- und Taktiltraining zur Modulation epigenetischer Programme (neuronale Plastizität erhöhen).
- Epigenetische Medikamente in der Forschung (HDAC-Inhibitoren zur Förderung der Sinnesfunktion). Histon-Deacetylase-Inhibitoren (HDAC-Inhibitoren) sind eine Klasse von Verbindungen, die die Aktivität von Histon-Deacetylasen hemmen und dadurch die Genexpression beeinflussen.
Kritische Aspekte von HDAC-Inhibitoren:
-
Unspezifische Wirkungen:
- HDAC-Inhibitoren können eine breite Palette von Genen beeinflussen, was zu unerwünschten Nebenwirkungen führen kann. Die Herausforderung besteht darin, spezifische HDAC-Isoformen gezielt zu hemmen, um die therapeutische Wirkung zu maximieren und Nebenwirkungen zu minimieren.
-
Langzeitwirkungen und Sicherheit:
- Die langfristigen Auswirkungen der HDAC-Hemmung sind noch nicht vollständig verstanden. Es besteht die Möglichkeit, dass dauerhafte Veränderungen in der Genexpression zu unvorhergesehenen gesundheitlichen Problemen führen könnten.
-
Epigenetische Plastizität:
- Epigenetische Modifikationen sind dynamisch und können durch Umweltfaktoren beeinflusst werden. Die Manipulation dieser Mechanismen durch HDAC-Inhibitoren könnte daher komplexe und nicht immer vorhersehbare Effekte haben.
Fazit
- Die altersbedingte Einschränkung der Sensorik ist nicht nur genetisch bedingt, sondern auch stark durch epigenetische Mechanismen reguliert.
- Umweltfaktoren, Stress, Ernährung und Lebensstil beeinflussen die epigenetische Regulation sensorischer Gene.
- Gezielte Prävention z.B. 100% bioaktives SAM-e – S -Adenosylmethionin – Supplementation kann helfen, epigenetische Alterungsprozesse der Sinneswahrnehmung zu verlangsamen.

100 % active
SAM-e
S-Adenosylmethionin
singulärerer DNA- und Histon-Methylgruppen-Spender
als S/S-Isomer 100% biologisch wirksam
(S/S)-S-Adenosylmethionin (SAM-e, Ademetionin) und Produkte
www.nugenis.eu/shop/
Ihr
Eduard Rappold
