Proteinsynthese und die Bedeutung von S-Adenosylmethionin (SAM, Ademetionin) und SPERMIDIN
„Protein ist Leben“ – Die fundamentale Rolle der Proteine in biologischen Systemen
Der Satz „Protein ist Leben“ fasst eine der zentralen Erkenntnisse der modernen Biologie zusammen: Proteine sind die essenziellen molekularen Maschinen, die nahezu alle Lebensprozesse steuern und ermöglichen.
Die komplexesten molekularen Maschinen sind die in den Zellen vorkommenden Proteine. Diese umfassen die Motorproteine wie Myosin, das verantwortlich ist für die Muskelkontraktion, Kinesin, das die Organellen in den Zellen mit Mikrotubuli vom Zellkern wegtransportiert, Dynein, das die Bewegung der Geißeln hervorruft und membranständige ATPasen wie die ATP-Synthase.
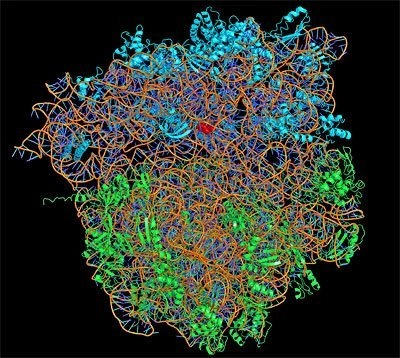
Die wahrscheinlich bedeutendsten biologischen Maschinen sind die Ribosomen. In der Tat sind Mikrotubuli Nanomaschinen, die aus über 600 Proteinen in Molekülkomplexen bestehen.
https://www.spektrum.de/video/molekulare-maschinen-arbeiter-in-der-zelle/1592546
Während DNA die genetische Information speichert und RNA als Bote fungiert, sind es die Proteine, die als Katalysatoren, Strukturbestandteile und Regulatoren die eigentlichen Lebensfunktionen ausführen. Ohne Proteine gäbe es kein Leben, wie wir es kennen.
Proteinsynthese: Wie Leben aus Protein entsteht
Proteinsynthese ist ein essenzieller, regulierter Prozess, der durch Ribosomenarchitektur, epigenetische Kontrolle und molekulare Stabilisierung optimiert wird.
Sowohl S-Adenosylmethionin (SAM, Ademetionin) als auch Spermidin spielen eine wesentliche Rolle bei der Förderung der Proteinsynthese am Ribosom, wenn auch auf unterschiedliche Weise. Ihre Funktionen sind direkt mit der Stabilisierung der ribosomalen RNA (rRNA), der Optimierung der Ribosomenfunktion und der Steuerung der Translationseffizienz verbunden.
Die Synthese von Proteinen erfolgt durch ein hochpräzises System:
- Transkription: DNA wird in mRNA umgeschrieben.
- Translation: Ribosomen sind der Ort, an dem im Inneren der Zelle genetische Information in Proteine umgesetzt wird. Ribosomen lesen die mRNA und setzen Aminosäuren zu einem Protein zusammen.
- Faltung und Modifikation: Chaperone helfen, das Protein in seine funktionelle 3D-Struktur zu bringen. Demnach entlässt das Ribosom die Proteine nach der Synthese nicht in das Zytosol. Stattdessen hält es sie dort so lange fest, bis bestimmte Helfer – sogenannte Chaperone – die passenden Gegenstücke anliefern. Damit stelle das Ribosom sicher, dass nur die eine, gewünschte Struktur ausgebildet werden kann; es übernimmt sozusagen neben der Produktion auch noch die Rolle eines Qualitätskontrolleurs. Die Proteine würden viel zu lange benötigen, um sich zu Komplexen zusammenzuschließen, da sie an „falschen“ Bestandteilen hängen bleiben und so Verklumpungen bilden, die im schlimmsten Fall gravierende Funktionsstörungen verursachen. Molecular Crowding heißt diese drangvolle Enge in der Zelle. Fehlgefaltete Proteine gelten außerdem als Verursacher zahlreicher Krankheiten – von Diabetes bis zu Alzheimer.
Wo findet die Proteinsynthese statt?
Die Proteinsynthese findet in Ribosomen statt, die sich in verschiedenen Zellkompartimenten befinden. Je nach Funktion des Proteins werden die Ribosomen entweder frei im Zytoplasma oder an das raue endoplasmatische Retikulum (rER) gebunden.
| Ort der Proteinsynthese | Funktion der Ribosomen | Beispielproteine |
|---|---|---|
| Freie Ribosomen (Zytoplasma) | Synthese zytosolischer Proteine | Aktin, Tubulin, Enzyme |
| Gebundene Ribosomen (rER) | Synthese exportierter/membrangebundener Proteine | Insulin, Ionenkanäle |
| Mitochondriale Ribosomen | Synthese mitochondrialer Proteine | Cytochrom-C-Oxidase |
Der Ort der Proteinsynthese bestimmt die Funktion des Proteins
✅ Proteine für das Zellinnere entstehen an freien Ribosomen.
✅ Proteine für den Export oder die Membranproduktion entstehen an gebundenen Ribosomen (rER).
Die ribosomale RNA (rRNA) ist ein essenzieller Bestandteil der Ribosomen und bildet die strukturelle und katalytische Grundlage für die Proteinsynthese in allen lebenden Organismen. Ihre Stabilität ist entscheidend für die Effizienz der Translation, die Zellgesundheit und die Anpassungsfähigkeit an Umweltbedingungen.
Ohne Ribosomen wäre kein Leben möglich – sie sind die molekularen Fabriken der Zelle!
Faktoren, die die rRNA-Stabilität beeinflussen
a) Struktur und chemische Modifikationen
- rRNA ist hochkonserviert (LUCA) und besitzt eine komplexe Sekundär- und Tertiärstruktur, die ihre Stabilität erhöht.
> Die ribosomale RNA (rRNA) bildet das strukturelle und funktionelle Rückgrat der Ribosomen. Ihre komplexe Sekundär- und Tertiärstruktur ermöglicht die präzise Faltung, Stabilisierung und Funktion des Ribosoms in der Proteinsynthese.
> LUCA – Last universal common ancestor und rRNA: Das ribosomale Translationssystem war bereits in LUCA vorhanden und hat sich über Milliarden Jahre erhalten. LUCA war also vermutlich ein RNA-dominierter Organismus mit einer frühen Form von Ribosomen – ein zentraler Schritt in der Evolution des Lebens. Leben könnte schon vor 4,1 Milliarden Jahren existiert haben:Mikrofossilien in 3,5 Mrd. Jahre alten Stromatolithen (Australien, Grönland, Südafrika) und Isotopensignaturen von Kohlenstoff (Graphit) in 4,1 Mrd. Jahre alten Gesteinen (Jack Hills, Australien) deuten auf biologische Prozesse hin.
- Chemische Modifikationen wie Methylierung und Pseudouridinierung stabilisieren die rRNA gegen Abbau.
b) Proteinschutz durch ribosomale Proteine (rProteine)
- Ribosomale Proteine binden an die rRNA und verhindern deren Degradation.
- Beispiel: Spermidin und S-Adenosylmethionin (SAM, Ademetionin) fördern die Faltung und Stabilität der rRNA.
c) Epigenetische Kontrolle und rRNA-Methylierung
- S-Adenosylmethionin (SAM, Ademetionin) ist der zentrale Methylgruppendonator für rRNA-Modifikationen.
- m6A- und m5C-Modifikationen erhöhen die rRNA-Stabilität und beeinflussen die Translationseffizienz.
S-Adenosylmethionin (SAM, Ademetionin) und Spermidin spielen in diesem Prozess zentrale, aber unterschiedliche Rollen
- S-Adenosylmethionin (SAM, Ademetionin) ist ein universelles, uraltes Biomolekül, das als zentraler Methylgruppendonator in nahezu allen lebenden Organismen fungiert. Seine Funktion in Methylierungsreaktionen, Epigenetik, RNA-Modifikationen und der Biosynthese von Cofaktoren deutet darauf hin, dass S-Adenosylmethionin (SAM, Ademetionin) bereits beim Last Universal Common Ancestor (LUCA) eine essenzielle Rolle spielte. Phylogenetische Analysen von S-Adenosylmethionin (SAM, Ademetionin)-abhängigen Enzymen zeigen eine tiefe evolutionäre Konservierung, die darauf hinweist, dass S-Adenosylmethionin (SAM, Ademetionin) bereits in LUCA existierte. SAM-abhängige Methyltransferasen sind in allen bekannten Lebensformen vorhanden und strukturkonserviert.
Vergleich der evolutionären Reihenfolge:
S-Adenosylmethionin (SAM, Ademetionin) ist eines der fundamentalsten biochemischen Moleküle und vermutlich älter als das Spermidinsystem.
Das Spermidinsystem konnte erst entstehen, nachdem SAM als Aminopropylgruppendonator verfügbar war.
| Molekül / System | Evolutionäre Entstehung | Funktion |
|---|---|---|
| S-Adenosylmethionin (SAM, Ademetionin) | Sehr früh, vermutlich in der RNA-Welt (~3,5–4 Mrd. Jahre) | Universeller Methylgruppen-Spender, Epigenetik, Neurotransmitter, Polyaminsynthese |
| Spermidinsystem (Aminopropylation) | Später als SAM (~3,0–3,5 Mrd. Jahre) | Zellwachstum, Ribosomenstabilisierung, Autophagie
|
Die Proteinsynthese wird auf mehreren Ebenen reguliert:
> Regulation durch Translationsfaktoren
- mTOR-Signalweg (Eukaryoten): Fördert die Translation, wenn Nährstoffe und Energie verfügbar sind.
- eIF2-Phosphorylierung: Verhindert Initiation unter Stressbedingungen.
- Ribosomale Stalling-Mechanismen: Verhindern Fehltranslationen und proteotoxische Schäden.
> Epigenetische Kontrolle durch S-Adenosylmethionin (SAM, Ademetionin)
S-Adenosylmethionin (SAM, Ademetionin) ist ein universeller Methylgruppendonator und essenziell für zahlreiche Prozesse:
-
- Epigenetische Regulation (DNA- und Histon-Methylierung),
- Biosynthese von Neurotransmittern (z. B. Methylierung von Noradrenalin zu Adrenalin),
- Synthese von Polyaminen (inklusive Spermidin),
- Beteiligung am Schwefelmetabolismus (Homocystein-Zyklus).
- S-Adenosylmethionin (SAM, Ademetionin)-vermittelte Methylierungen sind ein Schlüsselmechanismus zur Erhöhung der Ribosomenstabilität.
- S-Adenosylmethionin (SAM, Ademetionin) ist der wichtigste Methylgruppendonator für zahlreiche RNA-Modifikationen, S-Adenosylmethionin (SAM, Ademetionin) ist der primäre Methylgruppendonator für zahlreiche RNA-Modifikationen, einschließlich der rRNA-Methylierung. Diese Modifikationen optimieren die Ribosomenfunktion und damit die Proteinsynthese.
- S-Adenosylmethionin (SAM, Ademetionin)-meditierte Methylierung der rRNA beeinflusst die Translationseffizienz.
- S-Adenosylmethionin (SAM, Ademetionin) reguliert Histon- und DNA-Methylierung, die indirekt die Expression ribosomaler Proteine steuert.
> Die Rolle von Spermidin in der Ribosomenfunktion
- Spermidin stabilisiert die rRNA durch elektrostatische Wechselwirkungen.
- Erhöht die Translationsgeschwindigkeit und Genauigkeit durch Optimierung der Peptidyltransferase-Funktion.
> S-Adenosylmethionin (SAM, Ademetionin) und Spermidin – zwei sich ergänzende Mechanismen für die rRNA-Stabilisierung
| Molekül | Mechanismus | Funktion in der rRNA-Stabilisierung | Evolutionäre Bedeutung |
|---|---|---|---|
| S-Adenosylmethionin (SAM, Ademetionin) | Methylierung von rRNA | Erhöht chemische Stabilität, schützt vor Abbau, verbessert Translationseffizienz | Sehr früh (RNA-Welt), essenziell für alle Lebewesen |
| Spermidin | Elektrostatische Stabilisierung | Neutralisiert negative Ladungen der rRNA, erleichtert Ribosomenassemblierung | Entwickelte sich später, wichtig für schnelle Zellteilung |
> S-Adenosylmethionin (SAM, Ademetionin) und Spermidin fördern die Proteinsynthese auf verschiedenen Ebenen
| Molekül | Mechanismus | Auswirkungen auf die Proteinsynthese |
|---|---|---|
| S-Adenosylmethionin (SAM, Ademetionin) | rRNA- und tRNA-Methylierung | Optimiert Ribosomenfunktion, verbessert Translationseffizienz |
| S-Adenosylmethionin (SAM, Ademetionin) | Epigenetische Genregulation | Steuert Ribosomenproduktion auf transkriptioneller Ebene |
| S-Adenosylmethionin (SAM, Ademetionin) | Vorstufe für Spermidinsynthese | Indirekte Förderung der Translation |
| Spermidin | Elektrostatische Stabilisierung | Erhöht Ribosomenintegrität, verhindert Fehlfaltung |
| Spermidin | Verbesserung der mRNA-/tRNA-Bindung | Erhöht Translationsgeschwindigkeit und Genauigkeit |
| Spermidin | Förderung der Autophagie | Erhält Ribosomenfunktion durch Abbau beschädigter Komponenten |
S-Adenosylmethionin (SAM, Ademetionin) und Spermidin sind zentrale Regulatoren der Proteinsynthese und arbeiten synergetisch, um die Ribosomenstruktur und Translationseffizienz zu optimieren.
S-Adenosylmethionin (SAM, Ademetionin) als auch Spermidin spielen eine wesentliche Rolle bei der Förderung der Proteinsynthese am Ribosom, wenn auch auf unterschiedliche Weise.
Ihre Funktionen sind direkt mit der Stabilisierung der ribosomalen RNA (rRNA), der Optimierung der Ribosomenfunktion und der Steuerung der Translationseffizienz verbunden.
✅ S-Adenosylmethionin (SAM, Ademetionin) erhöht die Proteinsynthese, indem es die Ribosomenstruktur durch Methylierung optimiert und die Translationseffizienz steigert.
✅ S-Adenosylmethionin (SAM, Ademetionin) ist für die Spermidinsynthese essenziell, das ebenfalls die Translation unterstützt.✅ S-Adenosylmethionin (SAM, Ademetionin) beeinflusst indirekt die Ribosomenproduktion durch epigenetische Regulation.
✅ S-Adenosylmethionin (SAM, Ademetionin) ist für die Regulation der Spermidinsynthese essenziell, das ebenfalls die Translation unterstützt. S-Adenosylmethionin (SAM, Ademetionin) ist der Vorläufer der Spermidinsynthese, indem es die Aminopropylgruppen für die Polyaminsynthese liefert.
Ohne S-Adenosylmethionin (SAM, Ademetionin) gäbe es keine Spermidinproduktion, was wiederum eine direkte Auswirkung auf die Ribosomenstabilität hätte.
S-Adenosylmethionin (SAM, Ademetionin) war evolutionär früher vorhanden, da es bereits in RNA-Welten für Methylierungen genutzt wurde.
Spermidin entstand später als spezifischer Mechanismus zur elektrostatischen Stabilisierung der rRNA, wurde aber schnell essenziell für Ribosomenfunktion und Zellwachstum.
✅ Ohne S-Adenosylmethionin (SAM, Ademetionin) und Spermidin wäre die Translation ineffizient, instabil oder fehleranfällig.
✅ In schnell wachsenden Zellen (z. B. Krebszellen oder embryonalen Zellen) sind S-Adenosylmethionin (SAM, Ademetionin)– und Spermidinspiegel hoch, um die Proteinproduktion aufrechtzuerhalten.
- Studien zeigen, dass Spermidin für die korrekte Faltung und Assemblierung der Ribosomen erforderlich ist.
- Fehlt Spermidin, ist die rRNA instabil, was zu fehlerhaften Ribosomen und ineffizienter Proteinsynthese führt.
- Besonders wichtig in schnell wachsenden Zellen, wo ein hoher Bedarf an funktionalen Ribosomen besteht.
✅ Spermidin ist ein Polyamin, das für Zellwachstum, Translation und Autophagie essenziell ist.
Spermidin ist ein Polyamin, das für Zellwachstum, Translation und Autophagie essenziell ist.
✅ Spermidin stabilisiert Ribosomen durch elektrostatische Wechselwirkungen.
✅ Spermidin ist ein essenzieller Regulator der Proteinsynthese, insbesondere in schnell proliferierenden Zellen oder unter Stressbedingungen und die Steigerung der Proteinsynthese ist signifikant (~Faktor 2).
✅ Spermidin verbessert die mRNA- und tRNA-Bindung und erhöht die Translationsrate.
✅ Spermidin schützt Ribosomen durch Förderung der Autophagie.
✅ Diese Mechanismen sind evolutionär konserviert und essenziell für alle zellulären Organismen.

S-Adenosylmethionin (SAM-e, Ademetionin) und seine Wirkung auf das Gehirn
(S/S)-S-Adenosylmethionin (SAM-e, Ademetionin) und Produkte

SPERMIDIN
3 mg / Kapsel
60 Kapseln
aus Weizenkeimextrakt hergestellt
schützt Ribosomen und Zellen durch Förderung der Autophagie
https://nugenis.eu/shop/

SOYUP – SPERMIDINE
SOJAPULVER mit hohem SPERMIDINGEHALT
40 Portionen
https://nugenis.eu/shop/
Ihr
Eduard Rappold
